第二节 制备单克隆抗体的基本技术
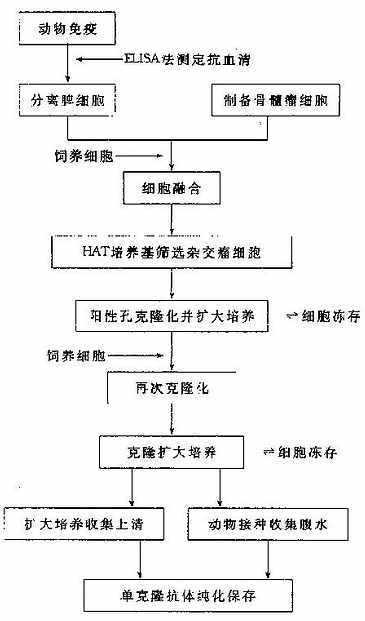
制备单克隆抗体是复杂而费时的工作,整个技术流程如图11-2。
(一)抗原提纯与动物免疫
对抗原的要求是纯度越高越好,尤其是初次免疫所用的抗原。如为细胞抗原,可取1×107个细胞作腹腔免疫。可溶性抗原需加完全福氏佐剂并经充分乳化,如为聚丙烯酰胺电泳纯化的抗原,可将抗原所在的电泳条带切下,研磨后直接用以动物免疫。
选择与所用骨髓瘤细胞同源的BALB/c健康小鼠,鼠龄在8~12周,雌雄不限。为避免小鼠反应而不佳或免疫过程中死亡,可同时免疫3~4只小鼠。
免疫过程和方法与多克隆抗血清制备基本相同,因动物、抗原形式、免疫途径不同而异,以获得高效价抗体为最终目的。免疫间隔一般2~3周。一般被免疫动物的血清抗体效价越高,融合后细胞产生高效价特异抗体的可能性越大,而且单克隆抗体的质量(如抗体的浓度和亲和力)也与免疫过程中小鼠血清抗体的效价和亲和力密切相关。末次免疫后3~4天,分离脾细胞融合。
(二)骨髓瘤细胞及饲养细胞的制备
选择瘤细胞株的最重要的一点是与待融合的B细胞同源。如待融合的是脾细胞,各种骨髓瘤细胞株均可应用,但应用最多的是Sp2/0细胞株。该细胞株生长及融合效率均佳,此外,该细胞株本身不分泌任何免疫球蛋白重链或轻链。细胞的最高生长刻度为9×105/ml,倍增时间通常为10~15h。融合细胞应选择处于对数生长期、细胞形态和活性佳的细胞(活性应大于95%)。骨髓瘤细胞株在融合前应先用含8-氮鸟嘌呤的培养基作适应培养,在细胞融合的前一天用新鲜培养基调细胞浓度为2105/ml,次日一般即为对数生长期细胞。

图11-2杂交瘤技术制备单克隆抗体的流程
在体外培养条件下,细胞的生长依赖适当的细胞密度,因而,在培养融合细胞或细胞克隆化培养时,还需加入其他饲养细胞(feedercell)。常用的饲养细胞为小鼠的腹腔细胞,制备方法为用冷冻果糖液注入小鼠腹腔,轻揉腹部数次,吸出后的液体中即含小鼠腹腔细胞,其中在巨噬细胞和其他细胞。亦有用小鼠的脾细胞、大鼠或豚鼠的腹腔细胞作为饲养细胞的。
在制备饲养细胞时,切忌针头刺破动物的消化器官,否则所获细胞会有严重污染。饲养细胞调至1×105/ml,提前一天或当天置板孔中培养。
(三)细胞融合
细胞融合是杂交瘤技术的中心环节,基本步骤是将两种细胞混合后加入PEG使细胞彼此融合。其后吧培养液稀释PEG,消除PEG的作用。将融合后的细胞适当稀释,分置培养板孔中培养。融合过程中有几个问题应特别注意。①细胞比例:骨髓瘤细胞与脾细胞的比值可从1:2到1:10不等,常用1:4的比例。应保证两种细胞在融合前都具有较高活性。②反应时间:在两种细胞的混合细胞悬液中,第1min滴加4.5ml培养液;间隔2min滴加5ml培养液,尔后加培养液50ml。③培养液的成分:对融合细胞,良好的培养液尤其重要,其中的小牛血清、各种离子和营养成分均需严格配制。如融合效率降低,应随时核查培养基情况。
(四)有限稀释法
筛选阳性株一般选用的骨髓瘤细胞为HAT敏感细胞株,所以只有融合的细胞才能待续存活一周以上。融合细胞呈克隆生长,经有限稀释后(一般稀释至0.8个细胞/孔),按Poisson法计算,应有36%的孔为1个细胞/孔。细胞培养至覆盖0%~20%孔底时,吸取培养上清用ELISA检测抗体含量。首先依抗体的分泌情况筛选出高抗体分泌孔,将孔中细胞再行克隆化,尔后进行抗原特异的ELISA测定,选高分泌特异性细胞株扩大培养或冻存。
(五)单克隆抗体的制备和冻存
筛选出的阳性细胞株应及早进行抗体制备,因为融合细胞随培养时间延长,发生污染、染包体丢失和细胞死亡的机率增加。抗体制备有两种方法。一是增量培养法,即将杂交瘤细胞在体外培养,在培养液中分离单克隆抗体。该法需用特殊的仪器设备,一般应用无血清培养基,以利于单克隆抗体的浓缩和纯化。最普遍采用的是小鼠腹腔接种法。选用BALB/c小鼠或其亲代小鼠,先用降植烷或液体石蜡行小鼠腹腔注射,一周后将杂交瘤细胞接种到小鼠腹腔中去。通常在接种一周后即有明显的腹水产生,每只小鼠可收集5~10ml的腹水,有时甚至超过40ml。该法制备的腹水抗体含量高,每毫升可达数毫克甚至数十毫克水平。此外,腹水中的杂蛋白也较少,便于抗体的纯化。接种细胞的数量应适当,一般为5×105/鼠,可根据腹水生长情况适当增减。
选出的阳性细胞株应及早冻存。冻存的温度越低越好,冻存于液氮的细胞株活性仅有轻微的降低,而冻存在-70℃冰箱则活性改变较快。细胞不同于菌种,冻存过程中需格外小心。二甲亚砜(DMSO)是普遍应用的冻存保护剂。冻存细胞复苏后的活性多在50%~95%之间。如果低于50%,则说明冻存复苏过程有问题。
(六)单克隆抗体的纯化
单克隆抗体的纯化方法同多克隆抗体的纯化,腹水特异性抗体的浓度较抗血清中的多克隆抗体高,纯化效果好。按所要求的纯度不同采用相应的纯化方法。一般采用盐析、凝胶过滤和离子交换层析等步骤达到纯化目的,也有采用较简单的酸沉淀方法。目前最有效的单克隆抗体纯化方法为亲和纯化法,多用葡萄球菌A蛋白或抗小鼠球蛋白抗体与载体(最常用Sepharose)交联,制备亲和层析柱将抗体结合后洗脱,回收率可达90%以上。蛋白可与IgG1、IgG2a、IgG2b和IgG3结合,同时还结合少量的IgM。洗脱液中的抗体浓度可用紫外光吸收法粗测,小鼠IgG单克隆抗体溶液在A280nm时,1.44(吸光单位)相当于1mg/ml。经低pH洗脱后在收集管内预置中和液或速加中和液对保持纯化抗体的活性至关重要。