2.2 蛋白质的生化
2.2.1 蛋白质的化学
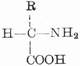
蛋白质分子是生物大分子,分子量约从5,000到数百万。其基本单位是氨基酸,通式为:

由于氨基和羧基都在α-C上,故称为α-氨基酸。式中R表示侧链。侧链不同,氨基酸的种类就不同。组成蛋白质的氨基酸一共有20种,各氨基酸按一定的排列顺序由肽键(酰胺键)联结成长链。肽键是由一个氨基酸残基的α-羧基和另一个氨基酸残基的α-氨其组成,如下所示:
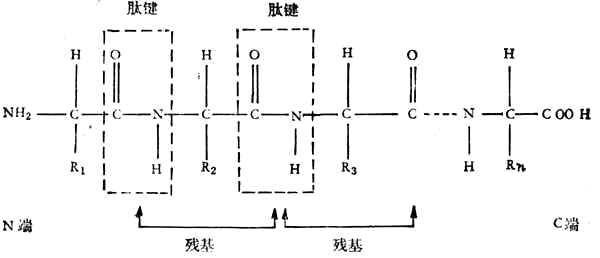
一个蛋白质分子由一个或几个肽链组成,每个链大约含有20到几百个氨基酸残基。肽链的氨基端称为N-端、羧基端称为C-端。蛋白质有一级结构、二级结构、三级结构、四级结构。一级结构只指肽链中氨基酸排列的顺序,二至四级结构表明主、侧链空间排列的关系。分子量超过1,000,000的蛋白质都有四级结构。
按照氨基酸侧链及氨基与羧基的数量,可将20种氨基酸分为三类(表2-1)。
这20种氨基酸在体内能参与蛋白质合成,都是人体所不可缺少的。其中异亮氨酸、亮氨酸、赖氨酸、蛋氨酸、苯丙氨酸、苏氨酸、色氨酸、缬氨酸、组氨酸(表2-1)9种,在体内不能自行合成,或合成速率不能满足机体需要,必须由食物供给。这些氨基酸称为必需氨基酸。9种中的组氨酸是婴幼儿必需氨基酸,婴儿缺乏时患湿疹。其余11种在体内能自行合成,称为非必需氨基酸。但是半胱氨酸和酪氨酸在体内能分别由蛋氨酸和苯丙氨酸合成,这两种氨基酸如果在膳食中含量丰富,则有节省蛋氮酸与苯丙氨酸两种必需氨基酸的作用,因此有时称为半需氨基酸。
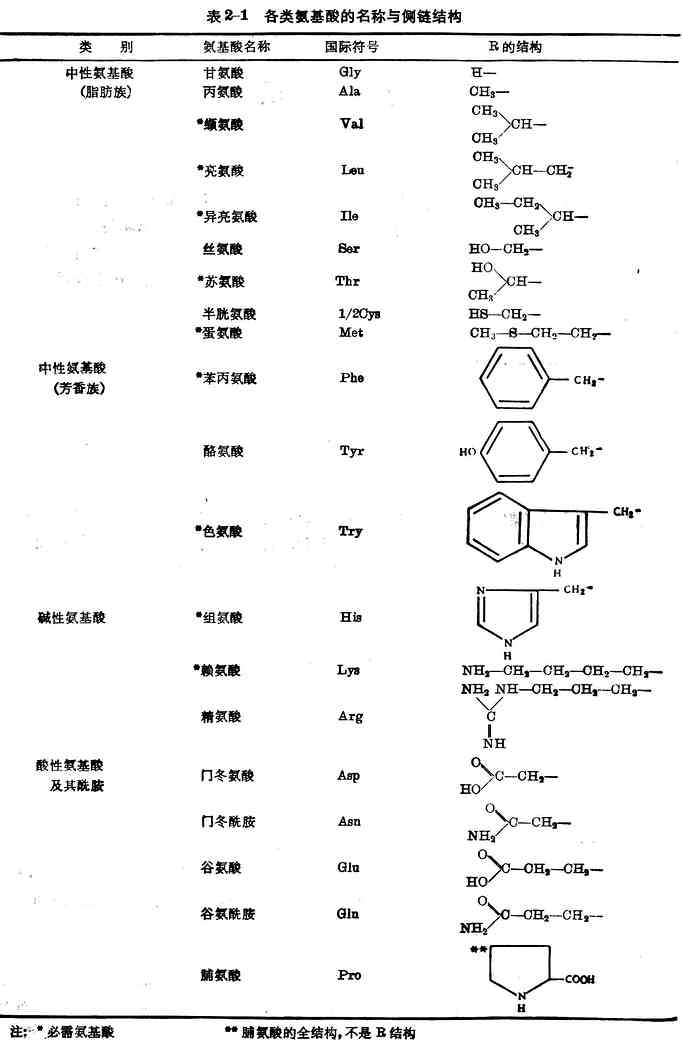
注:*必需氨基酸 **脯氨酸的全结构,不是R结构
蛋白质合成后,分子中某些氨基酸的衍生物。如两个半胱氨酸可借二硫键结合形成一个胱氨酸;胶原中的赖氨酸可羟基化成为羟赖氨酸;肌肉蛋白中的组氨酸经甲基化合成3-甲基组氨酸等。这些衍生物或者被排泄或继续分解代谢,不能再合成蛋白质。
从氨基酸的结构看,除甘氨酸外,其余氨基酸的α-碳原子都是不对称的,因而都具有旋光性。将α-碳原子的构型和甘油醛比较,可以见到蛋白质中的氨基酸都是L型的。L型和D型氨基酸的代谢反应不同,人体能利用所有的L型氨基酸而对D型的仅限于蛋氨酸和苯丙氨酸。
氨基酸分子上含有氨基和羧基,故称两性电解质,每一种氨基酸都有特定的等电点。氨基酸能与金属离子或酸生成盐、与醇生成酯、与有机酸形成酰胺化合物。氨基酸分子上还含有不少特殊基团,可与种种物质进行化学反应,参与机体代谢作用。在生化检验中,氨基酸能与某些试剂生成有色化合物,构成氨基酸定性、定量测定的基础。如大多数氨基酸与茚三酮反应生成蓝紫色化合物。
蛋白质由氨基酸组成,除具有与氨基酸相似的化学性质外,还有胶体性质和凝固、变性等现象。蛋白质颗粒大,且表面带有许多极性基团,在溶液中有高度的亲水性。因此蛋白质水溶液是一种较稳定的亲水胶体。少量的亲水胶全可以和大量水分结合,形成各种流动性不同的胶体系统,这就形成了各种组织细胞不同的形状、弹性和粘度。
蛋白质的分类方法很多。为了从不同角度了解蛋白质的概况,现将几种分类方法简介如下。
按照蛋白质中必需氨基酸的含量分类:
(1)完全蛋白 蛋白质组成中含有全部的人体必需氨基酸,如酷蛋白、卵蛋白。
(2)不完全蛋白 蛋白质组成中缺乏一种或几种人体必需氨基酸,如白明胶。
按照蛋白质的结构和溶解度分类:
(1)简单蛋白 包括动、植物组织中的白蛋白、球蛋白和植物组中的谷蛋白、麦醇溶蛋白,还有动物组织中含碱性氨基酸比较多的鱼精蛋白、组蛋白。
(2)硬蛋白 包括溶解度最低、不易消化的毛发、指甲、蹄、角中的角蛋白和皮肤、骨胳中的胶原蛋白、弹性蛋白。
(3)结合蛋白 包括在蛋黄中与磷酸组成的磷蛋白、与脂肪或类脂组成的脂蛋白和在骨胳、肌腱、消化液中与糖结合的粘蛋白、糖蛋白,与核酸、血红素、金属结合的核蛋白、血红蛋白、金属蛋白等。
按照蛋白质的功能分类:
(1)活性蛋白 包括在生命活动过程中一切有活性的蛋白质:如酶、激素蛋白、输送和储存蛋白、肌动蛋白、受体蛋白等。
(2)非活性蛋白 包括不具活性的、担任生物保护和支持作用的蛋白质:如胶原、角蛋白、弹性蛋白等。
以上各种分类方法都有一定的局限性,随着科学研究的发展,将不断补充修正。
2.2.2 游离氨基酸代谢库
体内氨基酸有结合型和游离型两种。结合型的浓度平均为2mol,而游离型约0.01mol,为结合型的0.5%。从幼年大鼠组织中氨基酸的分布看出,游离型必需氨基酸在组织和血浆中的浓度都很低,而丙氨酸、谷氨酸、谷氨酰胺和甘氨酸四种非必需氨基酸在组织中较高、血浆中则低(表2-2)。说明这几种非必需氨基酸能广泛在细胞内合成和储留。将体内游离必需氨基酸的浓度与大鼠每日氨基酸需要量比较(表2-2),游离氨基酸库每日必须转换数次才能满足大鼠生长的需要量。
表2-2 幼鼠(50g)体内氨基酸浓度和必需氨基酸需要量
| 蛋白质 | ||
| g·100g-1食物* | KJ·100kJ-1食物** | |
| 苹果 | 0.3 | 2.8 |
| 稻米(上白梗) | 6.7 | 7.8 |
| 带鱼 | 18.1 | 52.1 |
| 小麦粉(富强粉) | 9.4 | 10.7 |
| 土豆 | 2.3 | 11.9 |
| 花生米 | 26.2 | 19.2 |
| 瘦猪肉 | 16.7 | 20.2 |
| 鸡蛋 | 14.7 | 34.6 |
| 黄豆 | 36.3 | 35.2 |
| 豆腐(北) | 7.4 | 41.1 |
| 牛肉 | 20.1 | 46.7 |
血浆游离氨基酸经细胞膜进入组织细胞。在细胞上膜上具有转运中性、碱性、酸性各种类别氨基酸的载体,各类中不同氨基酸之间具有相互竞争的作用。
氨基酸在体内代谢途径可以归纳为三种:①掺入组织蛋白。经过一段时间后,随着组织蛋白的分解,又重入游离氨基酸库;②进行分解代谢。其碳架形成CO2呼出、或转化为糖原和脂肪蓄积,其氨基形成尿素排出;③合成其他含氮化合物,如嘌呤碱、肌酸、肾上腺素。这些物质继续降解不再返回游离氨基酸库。此外,还合成其他非必需氨基酸。
2.2.3 氨基酸转变为生理活性物质
氨基酸在体内主要是用来合成蛋白质,少量用于合成其他一些有生理活性的物质。
合成非必需氨基酸:酪氨酸和半胱氨酸分别由苯丙氨酸和蛋氨酸衍生而来,其他非必需氨基酸可由柠檬酸循环所产生的α-酮戊二酸或其他氨基酸与酮酸形成(图2-1)。
上述合成不普遍存在于各种组织,如苯丙氨酸只在肝脏受羟化酶催化而形成酪氨酸。
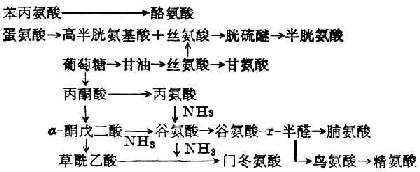
图2-1 非必需氨基酸的合成
嘌呤和嘧啶的生物合成:嘌呤和嘧啶碱可从食物供给,也能在体内自行合成。合成的主要原料是门冬氨酸、谷氨酰胺、甘氨酸等。
肌酸和肌酸酐的生物合成:肌酸由食物供给,也可以在体内从蛋氨酸、甘氨酸和精氨酸合成。肌酸由血液送至肌肉,被主动吸收,每天转换率为2%。体内大部分肌酸以肌酸和磷酸肌酸的形式储于骨胳肌。在静止的肌肉中则以磷酸肌酸为主,而在疲劳的肌肉中,磷酸肌酸浓度却很低。这是由于磷酸肌酸在磷酸肌酸转移酶的作用下,转变为肌酸和ATP的结果:

这个反应使肌肉在无氧条件下,能从磷酸肌酸获得附加的但数量有限的ATP。不论肌酸或者磷酸肌酸主要通过非酶脱水反应缓慢而不可逆地形成肌酸酐。肌酸酐不被利用,进入血液随尿排出,每日肌酸酐生成的量相当恒定,约为总肌酸库的1.7%。
2.2.4 蛋白质的生物合成和周转
蛋白质有高度的特异性。食物蛋白必须经过消化水解成为氨基酸而吸收,再合成人体所需要的各种蛋白质。蛋白质的合成体系主要由信使核糖核酸(mRNA)、转运核糖核酸(tRNA)、核糖核蛋白体核酸(rRNA)和某些蛋白质因子共同组成。mRNA是蛋白质合成的模板,tRNA是搬运氨基酸(原料)的工具,rRNA相当于装配机,促进氨基酸相互以肽键相结合。各种氨基酸在各自的搬运工具携带下,在装配机上按照模板的要求有次序地相互结合,生成具有一定氨基酸排列顺序的特定多肽链。合成后的多肽链,有的经过一定处理,有的与其他多肽链、糖、脂质等结合后形成具有生物活性的蛋白质。当合成原料(特别是必需氨基酸)供给不足时,可引起细胞内蛋白质合成减缓或停止。
每日蛋白质合成的量取决于生长、合成各种酶和修补组织细胞的需要。各种组织细胞合成与分解的速率差异很大,如小肠粘膜每1~2天更新一次而红细胞的寿命则约为120天;又如用同位素研究表明每天能合成血浆白蛋白10g、纤维蛋白2g,而幼年大鼠骨胳中胶原的生物半寿期却长达300天。用给予人体标记15N氨基酸方法估计不同年龄组成蛋白质合成的速率,得出体重约70kg的成年男子每日蛋白质合成量大于200g(表2-3)。这个数量超过成人每日蛋白质需要量或摄入量若干倍,因而可以理解陈旧蛋白质分解产生的氨基酸仍能用于蛋白质的再合成。
表2-3 不同年龄组总蛋白质合成率
| 年龄组 | 人数 | 体重(kg) | 年龄(范围) | 总蛋白质合成率(g.kg-1.d-1) |
| 新生儿(早产) | 10 | 1.94 | 1~46天 | 17.46 |
| 婴儿 | 4 | 9.0 | 10~20月 | 6.9 |
| 青年 | 4 | 71 | 20~23岁 | 3.0 |
| 老年 | 4 | 56 | 69~91岁 | 1.9 |
2.2.5 氨基酸的降解
各种氨基酸按照特定的化学反应进行降解。图2-2表明大鼠体内氨基酸降解的主要场所和产物。

图2-2 氨基酸主要降解场所与产物
有7种必需氨基酸主要在肝脏降解,其余异亮氨酸、亮氨酸、缬氨酸3种必需氨基酸(支链氨基酸)主要在肌肉中以及肾、脑中降解。支链氨基酸在肌肉中经转氨基作用变为丙酮酸和谷氨酸,继而分别形成丙氨酸和谷氨酰胺,再经血循环分别送到肝脏和肠。在肠壁转变为丙氨酸和谷氨酸。丙氨酸经门静脉送入肝脏,其氨基形成尿素、碳架经糖原异生作用转为糖(图2-3)。
尿素的形成几乎全部局限在肝脏中,因肝脏是唯一含有精氨酸酶的组织。首先是氨和CO2合成氨甲酰磷酸,然后经过瓜氨酸、精氨(酸代)琥珀酸、精氨酸等一系列合成反应(图2-4),最后精氨酸在精氨酸酶的催化下分解为尿素和鸟氨酸。鸟氨酸重返尿素合成的循环,尿素随尿排出。
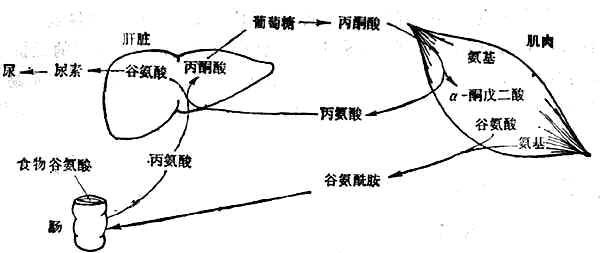
图2-3 葡萄糖-丙氨酸循环
CO2+NH3+ATP
↓

图2-4 尿素合成的途径
尿氨是蛋白质代谢的最终产物之一,在肾脏合成。由血浆送来的谷氨酰胺,在肾脏的近曲小管上皮细胞中,经谷氨酰胺酶催化水解为氨和谷氨酸盐。谷氨酸盐在谷氨酸脱氢酶的催化下,又产生氨和α-酮戊二酸。氨随尿排出;α-酮戊二酸经糖原异生作用形成葡萄糖,送入血循环重新利用。在饥饿或糖尿病等发生酸中毒的情况下,尿氨增多,肾脏既排泄氨又成了供给葡萄糖的场所。氨的形成也使身体保存了钠离子,否则钠离子将用于中和酸而被排出。