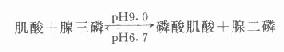
第二节 临床诊断中常用的血清酶类及其同工酶
上一节介绍了血清中酶浓度变化的机制以及在判断血清中酶测定结果的意义时必须注意的一些事项,但在具体应用各种酶测定来诊断疾病时,还各有其特点。
临床医师多从疾病出发,将酶测定结果和其它各种检查结果综合起来,分清主次,辨证地加以应用;对一个检验医师而言,单从这方面考虑显然是不够的,还应对具体每个酶有一个较全面的了解,这样才能为临床提供咨询,解释好各项测定的临床应用价值。
本节以常用的具体酶为中心,系统介绍该酶在临床论断中的应用,包括该酶的作用、性质特点、组织分布与其临床应用价值。
一、肌酸激酶(CK)及其同工酶
肌酸激酶(CK)催化下列反应:
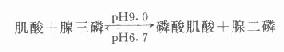
以前临床常习惯将此酶称为肌酸磷酸激酶(CPK),此名称不确切,目前国外已摒弃不用。此反应逆向反应速度约为正向反应速度6倍,与大多数激酶一样,Mg2+为它的辅基,需双硫键维持酶的分子结构。测定酶活性时必须加入巯基化合物,N-乙酰半胱氨酸(NAC)是目前最常用的激活剂。
CK作用生成的磷酸肌酸含高能磷酸键,是肌肉收缩时能量的直接来源,在3种肌组织和脑组织中含量最高。
CK是由两种不同亚基(M和B)组成的二聚体,这样正常人体组织常含3种同工酶,按电泳速率快慢顺序分别为:CK-BB(CK1),CK-MB(CK2)和CK-MM(CK3)。
除细胞质外,在心肌、骨骼肌和脑等组织细胞的线粒体内还存在另一种结构不同的CK,它也是二聚体,常简写为CK-MiMi,电泳时速度最慢,故命名为CK4。
【组织分布】
CK主要存在于骨骼肌、心肌、脑组织中,此外还存在于一些含平滑肌的器官如胃肠道,子宫内。而在肝、红细胞中含量极微或者没有。
骨骼肌无论在每克组织含量(328U/G湿重)还是绝对含量上都大大超过其它组织和器官。其中主要为CK-MM,不含CK-BB,仅有少量CK-MB(<3%)。心肌中CK虽只有骨骼肌的1/10(313U/G湿重),但CK-MB占CK总量的14%-42%,这在人体中是绝无仅有的。脑组织以及其中含平滑肌器官中的CK则几乎全部是CK-BB,它同时也是人胚胎中CK的主要存在形式。
【生理变异】
年龄、性别和种族对CK含量都有一定影响。
新生儿CK常为正常成年人的2-3倍。可能与分娩时骨骼肌损伤和缺氧有关,过6-10周可逐步下降接近成年人值。
CK含量和肌肉运动密切相关,其量和人体肌肉总量有关,男性参考值高于女性可能与这点有联系。国外调查,白种男性CK均值只为黑种人的66%,可能与种族有关,但也不排除两个人种之间体力劳动的差别。
【标本的采集、处理和贮存】
虽然红细胞中不含CK,但含有大量腺苷酸激酶(AK),目前常用的测CK的酶偶联法的反应体系中含有ADP。AK催化下列反应:
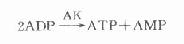
生成的ATP在指示酶6-磷酸葡萄糖脱氢酶作用下,可使NAD+生成NADH,340nm处吸光度升高,引起CK人为地升高。为去除AK的干扰,不少试剂盒中加入AK的抑制剂二腺苷-5-磷酸(DAPP)和AMP。但也有些试剂中未加入DAPP,此时溶血标本将产生明显干扰。
除肝素外,其它常用抗凝剂都能抑制CK活性。如不能及时测定,可将血清放冰箱贮存,-20℃中可长期保存。
【参考值范围】
成年男性参考上限为180U/L(37℃),女性为130U/L(37℃)。
正常血清中用电泳法查不到CK-BB,CK-MB不超过5%,如用免疫法测CK同工酶,依方法不同结果有异,可参考有关文献。
【临床应用】
CK及其同工酶是目前世界上临床测定次数最多的酶,80年代初期统计分别达一亿次和一千万次。这是因为CK在骨骼肌、心肌和脑疾患时常明显升高,如同时测定同工酶还有助于疾病的鉴别诊断。表7-4是各种疾病时CK的变化。
此酶测定主要用于早期诊断AMI和判断溶栓治疗的疗效以及判断疾病预后,特别在无Q波型AMI,此时心电图无Q波变化,常需其它检查来协助临床医师诊断和鉴别诊断AMI。目前有些国外学者认为在诊断AMI不需要同时作许多酶,只要单测CK一项即可。这是因为:
⑴心肌细胞含有大量CK:按每克组织含酶量计算,CK超过天冬氨酸转氨酶(AST,即谷草转氨酶)和乳酸脱氢酶(LD)等。所以当发生AMI、心肌细胞坏死时,释放出来的CK量超过其它酶。
⑵CK由于分子量不大,而且大量存在于胞质中,所以在各种酶中最早进入血液:一般在AMI后4-8小时就可能超过参考值上限。LD由于分子量大(约为125000),故增高明显迟于其它酶。同样线粒体中的酶,如线粒体AST在血中浓度升高明显推迟。
表7-4 总CK和CK同工酶在疾病时的变化
| 疾病 | 总CK | CK同工酶 | |
| 急性心肌梗死(AMI) | 常用酶中CK增高最早(4-8h),24h达峰值,2-3d恢复正常,中度升高,常在3000U/L以下 | 诊断AMI“金标准”(>6%),增高稍早于总CK(?),2-3天恢复正常 | |
| 心肌炎(病毒性,风湿性) | 急性期轻度升高,可达5倍正常上限 | CK-MB可增高 | |
| 增 | 心导管,冠状动脉造影 | 可有中度升高 | 一般无变化 |
| 运动试验) | 可轻度升高 | CK-MB正常 | |
| 肌肉损伤(挫伤、手术,肌注药物、癫痫、酒精和毒素中毒,过度运动) | 升高程度和损伤程度有关,严重病例可达10000U/L以上,肌注药物引起CK升高,一般不超过正常上限2倍,持续不超过一天 | 主要为CK-MM升高,CK-MB绝对值虽可升高,但百分比<6% | |
| 肌萎缩(Duchenne和Becker型) | 有症状患者CK可达50倍正常上限,女性携带者CK可为3-6倍正常上限,可查CK以筛选携带者 | 有些患者也可出现CK-MB升高 | |
| 多发性肌炎与肌炎 | CK明显增高 | 主要为CK-MM | |
| 高 | 神经性肌肉疾患 | CK正常 | 无变化 |
| 脑血管意外(脑出血,脑血栓) | 部分患者血中和CSF中CK升高 | CK-BB可增高 | |
| 恶性肿瘤 | 约10%病例CK-BB升高 | ||
| 甲状腺功能低下 | 可高达50倍正常上限 | 主要累及CK-MM | |
| Reye综合征 | 明显升高可在达70倍正常上限 | 主要为CK-MM | |
| 降 | 卧床患者 | 程度不等地下降 | 主要为CK-MM |
| 甲状腺功能亢进 | 程度不等地下降 | 主要为CK-MM | |
| 低 | 激素治疗 | 个别患者可下降 | 主要为CK-MM |
| 变 | Ⅰ型巨CK血症 | 电泳位于CK-MB和CK-MM之间可能是CK和IgA,或IgG复合物 | |
| 异 | Ⅱ型巨CK血症 | 电泳位于CK-MM后面,为线粒体CK和其聚合体 |
(3)由于CK主要存在于肌肉组织中,其它脏器如肝、肾、血细胞中含量极微:在诊断AMI时,其特异性远比一般代谢酶如LD、AST等为高,特别是溶血标本对CK测定结果影响较小。
近年来国内外使用动态法测定酶活性,大大提高了CK测定的准确性和重复性,并且可以在很短时间(约5分钟)测定完毕,特别适合于急诊患者。但CK测定的局限性也很明显,由于CK大量存在于3种肌肉组织中,尤其是骨骼肌中CK含量不论按浓度含量或按全身总量计算都大大超过心肌。因此骨骼肌局部或全身疾病都很容易引起血中总CK活性升高。血CK的极度增高主要见于全身疾病。曾有一例横纹肌溶解症患者,血中CK含量高达100000U/L,而在AMI时,就是大面积梗死,血中CK含量也很少超过3000U/L。肌注某些药物也可能引起CK一过性升高,但一般不超过正常上限值的2倍,持续时间不超过1天。因此国外有些医院将CK参考值上限的2倍作为诊断AMI的判断值,以减少假阳性。尽管CK测定诊断AMI的灵敏度很高,但特异性却明显偏低,其假阳性率达15%-30%。CK在体内的半寿期明显比其它酶短,心肌组织一次梗死后,CK急剧升高并很快恢复正常(48-72小时),这样在亚急性心肌梗死时CK可能正常,但其它酶如AST,特别是LD很可能居高不下。
以往对CK诊断AMI常强调下列几点:①AMI发病后8小时内查血CK不高,不应轻易除外AMI诊断,并以此结果作为基础值,和以后测定值作比较,任何怀疑AMI者应尽早抽血送检;②发病后24小时CK测定结果临床意义最大,因为此时正当CK的峰值时间,如不超过正常值上限可排除AMI诊断;③发病后48小时内应多次测CK活性,如不出现一个典型升高和下降的过程,应怀疑AMI的诊断。
近年文献指出,某些AMI患者血中CK可以不超过正常值,特别是不超过参考值上限的2倍,这些病例又多见于无Q波心肌梗死。长期以来认为CK峰值高低对AMI预后判断有一定价值。
CK-MB由于大量存在于心肌组织中,其它组织和器官中含量很少,所以CK-MB是目前诊断AMI的一个极其可靠的生化指标,特异性可达95%乃至更高。一般认为其灵敏度比CK总活性稍差,但也有文献报道,约有12.5%AMI患者总CK不高,但CK-MB超过正常。
CK-MB测定方法和试剂盒很多,同一标本不同实验室往往结果不同。从测定原理来分,可分为测酶活性与酶质量两大类方法。第一类方法先用物理、化学和免疫等各种手段将CK-MB和其它同工酶分开,然后根据酶的催化活性测CK-MB浓度,用活性单位/升(U/L)或百分比报告结果。测酶质量方法则是利用CK-MB的抗原性,根据抗原抗体反应测CK-MB酶蛋白浓度,单位为μg/L。两者结果有时不一致,因为如酶变性失活但仍保留抗原性,此时用测酶活性的方法结果不高,但用测质量方法可以增高。80年代早期德国学者根据此结果认为AMI患者血中存在着灭活的CK。但最近用改进方法测CK-MB,发现两法差异不大。国内普遍使用测酶活性方法,目前较多使用电泳方法分离CK-MB。电泳法特点是准确可靠,当出现一些异常同工酶如巨CKⅠ、巨CKⅡ等,从电泳图谱上很容易发现,并可通过光密度计进行定量测定,不会将CK-BB和各种异常同工酶误认为是CK-MB而误诊。其主要缺点是灵敏度较差。
近年来国内一些单位用免疫抑制法测CK-MB,其原理为抗M亚单位的抗血清可以和CK-MM及CK-MB中的M亚单位形成抗原抗体复合物,从而完全抑制M亚单位的酶活性,因为正常血清中几乎无CK-BB,故将此值乘以2可以认为大致代表CK-MB的活性。此法简单迅速,缺点是特异性差,如患者血清中还存在着CK-BB或者异常CK时,都将出现假阳性。故可作为过筛试验,如有疑问时用电泳法核实。另外此法正常值明显高于其它方法。如Sclavo公司试剂盒的正常值为18U/L,而电泳等其它方法都是<5U/L。有人认为这是因为CK-MM还可以进一步分为若干亚型,一般抗MM血清对MM3抑制较好,但对MM1抑制较差,而正常情况下血中MM亚型的存在以MM1为主,故导致正常值明显偏高。AMI第一天血中以MM3为主,但第二天以后则以MM1为主,因此使用此类方法诊断AMI和解释结果时应谨慎。
国外从80年代初建立了多种测CK-MB酶质量的方法。应用最多的是美国Hybriteeh公司的ELISA方法,正常人在5μg/L以下,此法结果和电泳法相关良好。缺点是测定时间长达半天,只适合成批标本。近两年来应用单克隆技术制备出特异性极高的只和CK-MB作用的抗血清,并已有多种试剂盒供应。最近Deerson以CK-MB≥10μg/L以及CK-MB指数≥3.0(μg/UCK×100)为AMI诊断标准。CK-MB单克隆抗体方法简单,特异性高,是目前重点发展的方法,近来有人认为此法有助于不稳定型心绞痛的诊断,可惜国内应用不多。
CK-MB的局限性在于骨骼肌损伤时也可能释放出一定量的CK-MB。虽一般认为骨骼肌含有的CK-MB在总CK中不超过5%,但也有例外。Evans报道1例横纹肌肉瘤的CK-MB高达274U/L,占总CK的28%。因此当CK-MB增高时,临床也应考虑有无非心肌来源的可能性。
骨骼肌中有大量CK,所以CK明显升高(3000U/L)大都见于肌肉疾病。此时CK测定用于鉴别肌萎缩病因,如Duchenne型和Becker型肌萎缩患者,常在临床前期血中CK就可中度和高度增加。该病是伴性遗传,在75%女性Duchenne型肌萎缩携带者和50%女性Becker型肌萎缩携带者血中也可查到CK升高。此外各种原因(病毒,细菌和寄生虫)引起的肌肉感染性疾病都能引起CK升高。但由于神经疾病引起的肌萎缩症,CK常不增高。
脑中虽含有较大量CK,脑血管意义时有大量CK释放入组织间隙,但由于血脑屏障存在,只能在部分病例中查到血中和脑脊液中CK升高,以及出现CK-BB,但阳性率不高,这妨碍了CK在这方面的临床应用。
人胚胎期主要为CK-BB,有人根据“癌胚”理论,提出CK-BB可作为肿瘤标记物,可惜的是阳性率不高,只占恶性肿瘤的10%左右。
二、乳酸脱氢酶(LD)及其同工酶
乳酸脱氢酶(LD)酶催化下列反应:
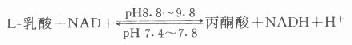
不同方法测出LD结果差异较大,这是因为LD有5种不同的同工酶,每种同工酶的最适反应条件不同。例如同为催化乳酸变为丙酮酸,LD1的最适pH为9.8,而LD5的最适pH为8.8。很难找出一个测定血清总LD的最适条件,检验医师在解释测定结果时应加以注意。
LD催化反应是无氧糖酵解的最终反应,广泛存在于人体各组织中,故测总酶临床意义不大,但LD是由两种不同亚基(M,H)组成的四聚体,形成5种结构不同的同工酶,其中H型亚基中酸性氨基酸较多,电泳时负电荷多,因此电泳速率较快。按电泳向阳极泳动快慢,分别命名为LD1(H4),LD2(H3M),LD3(H2M2),LD4(HM3)和LD5(M4)。
【组织分布】
LD虽广泛存在于人体各组织中,但是不同组织中同工酶组成有差异,大致可分为三类:一类以LD1为主,心肌为此类代表,LD可占总酶活性50%以上,此外有红细胞等。另一类以LD5为主,以横纹肌为代表,此外有肝脏等。第三类以LD3为主,脾、肺为此类代表。LD主要存在于细胞质中,线粒体中未查到。
【生理变异】
血清LD高低和性别关系不大,婴儿酶活性可达成年人两倍,儿童和少年活性比成年人高10%-15%,血清LD同工酶目前常用电泳法测定,由于具体方法差异,各学者报告的结果出入较大,但在成年人存在着如下规律:LD2>LD1>LD3>LD4>LD5,值得注意的是有学者报告,部分正常儿童血中LD1可大于LD2。
【标本的采集、处理和贮存】
由于血小板中也含大量LD,血清中和血浆所测LD有一定差异,一般都选用血清为测定标本,采血后应迅速分离血清,因红细胞中LD含量比血清高100倍以上,不宜用溶血血清为测定标本。
LD尤其是LD4和LD5与其它酶不同,不是热变性而是冷变性,在4℃贮存活性下降快于室温25℃,一般说25℃放2-3天LD活性变化不大,有条件者最好还是在采血后24小时内测定,标本应贮存于室温。
【参考值范围】
根据催化反应方向的不同,有两大类测LD方法,一大类为国际临床化学协会(IFFC)推荐方法,以丙酮酸为底物,其参考值范围为80-500U/L(37℃);另一大类以乳酸为底物,在我国应用较普遍,其参考值范围为50-150U/L。
【临床应用】
LD及其同工酶是临床上常用酶之一,尤其是LD同工酶和CK-MB是临床常规实验室最常测的两种同工酶。临床常用于诊断和鉴别诊断心、肝和骨骼肌的疾病。表7-5是LD及其同工酶在这些疾病时的变化情况。
表7-5 总LD和LD同工酶在疾病的变化
| 疾病 | 总LD | LD同工酶 | |
| AMI | 常测酶中,升高最慢(8-10h),但升高时间最长(5-10d),峰值可达10倍正常上限 | LD1>LD2,并可持续到两周(部分病例总LD正常) | |
| 充血性心衰,心肌炎 | 可升高达5倍正常上限 | LD1>LD2 | |
| 增 | 巨细胞性贫血 | 可升高达5倍正常上限,治疗正确迅速下降 | LD1>LD2 |
| 病毒性肝炎 | 部分病例可升高达5倍正常上限 | LD5>LD4(部分病例总LD正常 | |
| 肝硬化 | 常轻度升高 | LD5明显升高,LD5>LD4 | |
| 高 | 原发性肝癌 | 部分病例升高 | LD5明显升高,LD5>LD4 |
| 梗阻性黄疸 | 不定 | 常LD4>LD5 | |
| 肌肉损伤 | 视损伤程度不同而异 | 以LD5升高为主 | |
| 肌萎缩 | 可高达10倍正常上限 | 以LD5为主 | |
| 某些恶性肿瘤(白血病,结肠癌……) | 可升高,个别病例高达5倍正常上限 | 以LD3为主,LD3>LD1 | |
| 变异 | 某些病倒,电泳出现LD6,常显示预后不佳 |
实用中此酶用于诊断AMI,特别是亚急性AMI。在AMI时,LD由于分子量较大(125000),在常用酶中升高最迟,但其半寿期较长,增高持续时间可达5-10天,此时其它酶活性已恢复正常,在亚急性AMI诊断上有一定价值。可惜的是,LD总酶诊断AMI的特异性较差,很多其它疾病,此酶都升高。LD同工酶则不同,诊断特异性可达95%以上,仅次于CK-MB,甚至有学者认为,只要测此二同工酶,不需作其它酶学检查就可诊断AMI。LD同工酶的高特异性是因为人体各组织器官中LD同工酶的分布情况并不相同,除心肌外,只有少数器官如红细胞中的LD是以LD1为主,绝大多数的AMI患者血中的LD同工酶都可出现LD1>LD2变化,即所谓的“反转”(flip)类型变化,其持续时间甚至可超过总LD升高时间,达两周之久。临床上可见部分患者在恢复期,所有酶活性都降至正常,但仍有“反转”类型的LD同工酶变化,这些患者常有复发倾向,除AMI和心肌损伤,此种“反转”类型变化还见于溶血性贫血和巨细胞性贫血,但此类疾病在临床上不难与AMI相区分。
60年代临床上曾经用过所谓“α-羟丁酸脱氢酶”的测定来诊断AMI。实际上并不存在这种酶,所测的主要是LD1的活性,目前国外已较少测定此酶而改用更精确的测LD同工酶的方法。
其次,LD及其同工酶常用于肝脏疾病的诊断和鉴别诊断,由于肝细胞中主要为LD1,在肝实质病变时常出现LD5>LD4,但由于正常血清中LD5含量很少,不少病例就是出现同工酶异常LD5>LD4时,总LD活性仍为正常,故LD同工酶检查阳性率远高于总LD,一般在胆道疾患或梗性黄疸早期未累及肝实质时,不出现LD5>LD4,仍为LD4>LD5。值得注意的是,在骨骼肌疾病和损伤时,也会出现类似变化,临床上诊断各型肌萎缩也常测定LD及LD同工酶,早期常为LD5升高,但在晚期LD1和LD2也升高。
恶性肿瘤可由于肿瘤细胞恶性增长和坏死而引起血清LD升高,如转移到肝脏往往伴有LD4和LD5升高,此外一部分肿瘤,如白血病等常有LD3和LD4的增高。
三、氨基转移酶(ALT,AST)及其同工酶
氨基转移是氨基酸代谢中基本生化反应之一,在机体内存在着多达60种氨基转移酶,丙氨酸基转移酶(ALT)和天冬氨酸氨基转移酶(AST)是其中最重要的两种。
ALT催化下列反应:

AST催化下列反应:
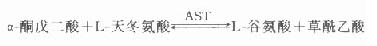
它们都需要磷酸吡哆醛(维生素B4)为辅基,不含磷酸吡哆醛的酶蛋白称为脱辅基酶蛋白,没有催化活性。血清除含有有活性的全酶外,还有部分不含磷酸吡哆醛的酶蛋白,如在测定前,先加入足量磷酸吡哆醛,所测血清转氨酶活性常有明显升高。
AST有两种受不同基因控制的同工酶分别存在于细胞质(c-AST)和线粒体(m-AST)中,而一般认为ALT不存在同工酶,我国学者证实在人组织和血清中也存在类似AST的两种同工酶,即细胞质ALT(c-ALT)和线粒体ALT(m-ALT)。
【组织分布】
AST广泛存在于多种器官中,按含量多少顺序为心脏、肝、骨骼肌和肾,还有少量存在于胰腺、脾、肺及红细胞中,肝中AST大部分(70%)存在于肝细胞线粒体中。
ALT也广泛存在于多种器官中,含量最多的不是心脏,而是肝,顺序为肝、肾、心、骨骼肌等,与AST相比,在各器官中含量都比AST少,肝中ALT绝大多数存在于细胞质中,只有少量在线粒体中。
【生理变异】
此二酶生理变异较小,性别、年龄、进食、适度运动对酶活性无明显影响,每天虽有生理性波动,但无统计学意义。
表7-6 ALT和AST在疾病时的变化
| 疾病 | ALT | AST | AST/ALT |
| 病毒性肝炎 | 随不同病期和严重程度而异,常明显升高,可达10-100倍正常上限 | 同ALT,但程度没有ALT明显,恢复到正常早于ALT | <1.0 |
| 重症肝炎 | 不超过20倍正常上限,出现“肝疸分离” | 增高程度常超过ALT | >1.0 |
| 肝硬化 | 变化不定,常轻度增高 | 同ALT,但增高程度常超过ALT | >1.0 |
| 右心衰竭合并肝溢血 | 正常或轻度升高,个别可高达10倍正常上限 | 增高程度常超过ALT | >1.0 |
| 梗阻性黄疸 | 变化不足,常不超过5倍正常上限 | 同ALT | 不定,常<1.0 |
| Gilbert综合征 | 无变化 | 无变化 | |
| 溶血性黄疸 | 无变化 | 无变化 | |
| AMI | 正常或轻度升高 | 明显升高,与CK和LD相比,无何优点 | >1.0 |
| 心肌炎 | 正常或轻度升高 | 急性期可轻度升高 | >1.0 |
| 肌肉损伤 | 正常或轻度升高 | 可高达2-5倍正常上限 | >1.0 |
| 肌萎缩 | 明显上升,可达8倍正常上限 | 同ALT | >1.0 |
【标本的采集、处理和贮存】
红细胞中AST和ALT分别为血清含量的15倍与7倍,所以明显溶血标本不宜测此二酶。
宜采用血清为测定标本,此二酶在4℃冰箱中贮存一周,活性无明显变化,最好不要冰冻,因为在融冻时很容易破坏酶的活性。
【参考值范围】
一般临床使用方法中不加入磷酸吡哆醛,其参考值范围较加入磷酸吡哆醛的为低,ALT为5-40U/L(37℃),AST为8-40U/L(37℃)。
【临床应用】
根据此二酶在人体器官中分布情况,临床医师习惯将ALT用在诊断肝脏疾病,测定AST诊断AMI。在AMI时,不论在出现升高时间,还是升高持续时间,其变化介于CK和LD之间,无特殊价值,随诊断AMI的新试验日益增多,国外已建议不用。ALT在AMI时一般不增高或轻度增高,明显升高常说明有右心衰竭合并肝淤血,m-AST变化比总酶更慢,但其增高程度与坏死病变程度密切相关,是判断AMI预后的一个很好指标。
目前转氨酶测定主要用于肝胆疾病的诊断和鉴别诊断。ALT是我国目前测定次数最多的酶,假如能同时测定AST,并计算出文献上常提到的Deritis比值,即AST/ALT之比,在诊断和鉴别诊断上将是很有用的。
(一)丙氨酸氨基转移酶(ALT)
以前常简称GPT,近年来国外多以ALT为此酶缩写。ALT是我国测定次数最多的酶,这是因为我国肝炎较多,而肝是含ALT最丰富的器官,且大部分存在于肝细胞的胞质中。肝炎时,细胞膜通透性增加,由于肝细胞中ALT浓度约比血清高7000倍,只要有1/1000的肝细胞中的ALT进入血液就足以使血中ALT升高1倍,故此酶是肝损伤的一个很灵敏指标。肝炎时早在黄疸前期就升高,峰值可达数千单位,为正常上限的百余倍。一般而言在急性肝炎时,血清ALT活性高低与临床病情轻重相平行,又由于ALT半寿期较长,往往是肝炎恢复期最后降至正常的酶,是判断急性肝炎是否恢复的一个很好指标。此外在慢性肝炎特别是慢性活动性肝炎ALT也经常升高。因此临床医师对急慢性肝炎患者经常检查ALT并据此诊断和判断病情。
应注意两种情况,重症肝炎时由于大量肝细胞坏死,此时血中ALT可仅轻度增高,临终时常明显下降,但胆红素却进行性升高,即所谓的“胆酶分离”,常是肝坏死征兆。另一种情况是少数人血清中ALT长期持续升高,肝穿无明显病理改变,预后良好,对此现象目前仍在研究之中。
肝炎时ALT常有明显变化,但不能反过来认为凡ALT升高者就有肝炎,其它肝胆疾病如胆石症、胆囊炎、肝癌和肝淤血时也可升高。由于肝脏以外不少器官也含有ALT,因此在AMI、多发性肌炎、急性肾盂肾炎等患者血中ALT也可升高,但一般而言,这些疾病ALT升高很少超过正常上限10倍,常以400U/L为界,超过此值绝大多数可诊断为肝炎。但也有例外,有人报告个别肝淤血、胆石症等患者可超过此界,但在这种情况时,ALT变化往往很快,过几天复查,ALT就可降至400U/L以下。
(二)天冬氨酸氨基转移酶(AST)
以前常简称GOT,现多以AST为缩称,既往认为AST主要存在于心肌中,主要用于诊断AMI。但目前由于AST在AMI时升高迟于CK,恢复早于LD,故诊断AMI价值越来越小,国外不少学者认为诊断AMI,完全可以不测AST。
另一方面肝中AST含量虽低于心肌,但绝对含量(U/mg)仍高于ALT。肝中AST和ALT含量比值约为2.5:1.0。只是由于ALT主要存在于细胞质中,AST主要存在于线粒体中,病变较轻的肝脏疾病如急性肝炎时血中ALT升高程度高于AST,但在慢性肝炎,特别是肝硬化时,病变累及线粒体,此时AST升高程度超过ALT。故在国外对疑是肝炎患者常同时测AST和ALT,并计算AST/ALT比值,正常约为1.15,急性肝炎第1、2、3和4周分别为0.7、0.5、0.3和0.2。如比值有升高倾向,应注意有无发展为慢性肝炎可能,慢性肝炎时可升到1.0以上,肝硬化时可达2.0,此比值对判断肝炎的转归特别有价值。
四、碱性磷酸酶(ALP)
碱性磷酸酶(ALP)是指一组底物特异性很低,在碱性环境中能水解很多磷酸单酯化合物的酶,需要镁和锰离子为激活剂。近年为认为ALP真正作用是将底物中磷酸基团转移到另一个含羟基基团化合物上,磷酸乙醇胺有可能是ALP在体内作用的底物。
ALP确切的生理作用目前仍不十分清楚,一般认为骨中ALP和骨的钙化作用密切相关,成骨细胞中的ALP作用产生磷酸,与钙生成磷酸钙沉积于骨中。ALP还广泛存在于肝细胞血窦侧和胆小管膜上、肾近侧曲管刷状缘和小肠粘膜的微绒毛,据此推测它可能还与物质的吸收和运转过程有关。
各器官的ALP在理化性质都有些差异,临床上长期认为存在着肝、骨、小肠和胎盘等ALP,在病理时还可能出现“高分子”ALP,以及一些和肿瘤有关的变异ALP,如Regan、NagaoALP等。深一步研究发现这些ALP主要受3个基因位点控制,相应生成3大类ALP,即小肠、胎盘和组织非特异ALP,后者包括临床上所谓的骨、肝、肾等组织器官,它们的氨基酸结构类似,抗原性无差别,这些酶电泳速率和对不同抑制剂反应差异来自ALP中所含糖基的不同。
【组织分布】
ALP广泛存在于机体各组织器官中,按每克湿组织ALP含量多少排列,顺序为肝、肾、胎盘、小肠、骨等。
【生理变异】
总论中已经提到ALP变化与年龄密切相关,简言之,新生儿ALP略高于成年人,以后逐渐增高,在1-5岁有一次高峰,可达成年人上限2.5-5倍,以后下降,到儿童身长增高期又再次上升,第二高峰在10-15岁之间,可达成人上限4-5倍。20岁后降至成年人值,到老年期又轻度升高,可能与生理性的激素变化有关。
孕妇血清ALP在妊娠3个月即开始升高,9个月可达峰值,约为正常值的2倍,ALP升高可维持到分娩后1个月,升高的ALP来自胎盘,和胚泡壁的细胞滋养层的发育程度直接相关。
高脂餐后,血清ALP活性升高,尤以血型为O型或B型的分泌型(唾液中可分泌血型抗原者)人群更为突出,增高的ALP多为小肠ALP。
【标本的采集、处理和贮存】
为避免脂肪餐的影响,宜空腹采血,除肝素外,其它常用抗凝剂可与Mg2+作用,引起ALP活性下降。最好用血清为测定标本,红细胞膜上有ALP,明显溶血标本会干扰测定结果。
ALP在室温和冰箱放置后,活性逐渐升高,可增加5%-10%。冷冻血清融冻后,其中活性开始偏低,以后慢慢升高。所以应在采血当日就测定ALP活性。
目前常用的冻干质控血清,复溶后ALP活性常有一个活性升高过程,有些制品复溶24小时后,活性可升高50%-100%,使用时应加以注意。
【参考值范围】
ALP测定结果与所用方法种类和测定温度密切相关,就是同一底物,因缓冲液不同,其结果可有2-3倍差异,目前国内应用较多的方法中以磷酸对硝基酚为底物,2-氨基-2-甲基丙醇为缓冲液,在37℃测定时,成年人参考值范围为20-110U/L。
ALP在不同年龄人群中有较大差异,在以上有关章节中已加以论述,解释结果时必须加以注意。国外文献指出ALP虽然有较大的人群差异,但是个体间差异很小。有条件应将测定结果与被测者的“正常值”进行比较。
【临床应用】
ALP早在本世纪30年代就用于临床,是临床医师非常熟悉的酶之一,在70年代前ALP是世界上临床测定次数最多的酶,主要用于骨骼和肝胆系统疾病的诊断和临床鉴别诊断,可参见下表:
表7-7 碱性磷酸酶在疾病时的变化
| 增 高 | |
| 变形性骨炎(Paget病) | 极度上升,可达50倍正常上限 |
| 骨肿瘤 | 中度上升 |
| 佝偻病(软骨症) | 可升达1-3倍正常上限 |
| 骨折 | 轻度升高 |
| 梗阻性黄疸 | 明显升高,可达10-15倍正常上限 |
| 肝实质疾病(肝炎,肝硬化) | 轻度上升,很少超过3倍正常上限 |
| 肝癌(原发,继发) | 常明显上升,可达5-10倍正常上限无黄疸有ALP升高应考虑肝占位性病变下降 |
| 下 降 | |
| 甲状腺功能低下 | |
| 恶性贫血等 | |
| 遗传性碱性磷酸酶缺乏或下降症 |
ALP和骨化过程密切相关,很多骨骼疾病如变形性骨炎(Paget病)、副甲状旁腺功能亢进、佝偻病、软骨症、原发性和继发性骨肿瘤、骨折和肢端肥大症的患者血中ALP都可升高,尤其是变形性骨炎,增高非常明显,可达正常上限值的50倍。此病在我国少见,我国常用于早期诊断佝偻病和软骨病,ALP升高早于血钙、磷变化以及X线检查,是一个很灵敏的诊断指标,但应注意骨质疏松患者血中ALP一般都在正常范围内。
目前ALP测定主要用于黄疸的鉴别诊断,阻塞性黄疸时血清ALP常早期明显升高,甚至可达正常上限值的10-15倍,在完全阻塞性黄疸病例中,80%病例血中ALP超过正常上限5倍。一般而言血清ALP持续低于正常上限值2倍时,阻塞性黄疸可能性较小,肝性黄疸时ALP轻度升高,一般不超过正常上限的2-3倍,约有半数原发性肝癌血中ALP升高,升高程度也常较明显,甚至可达正常上限值的15-20倍。如在无黄疸肝脏疾病人血中发现有ALP升高应警惕有无肝癌可能。
ALP升高还可见于其它疾病,如急慢性胰腺炎、慢性肾衰、肠梗塞、肺梗塞等疾病,但无太大临床价值,某些药物如孕激素、雌激素、胎盘白蛋白等也可引起血中ALP升高。
血ALP下降见于甲状腺功能低下、恶性贫血和遗传性碱性磷酸酶减少症等。
五、γ-谷氨酰基转移酶及其同工酶
γ-谷氨酰基转移酶(GGT)是一种底物特异性不高的酶,可作用于一系列含谷氨酰基的化合物。在体内可能催化下列反应:

由于有多个多肽参与反应,历史上曾命名为γ-谷氨酰基转肽酶,简写为GGTP。
本酶为含SH基的糖蛋白,其生理功能尚不十分清楚。Meister认为细胞外游离氨基酸需通过γ-谷氨酰基循环的一系列生化反应方能进入细胞,位于细胞膜上的本酶起关键作用,与组织中氨基酸和肽的分泌吸收,合成过程有关。
不同器官GGT的理化性质有差异,用琼脂糖电泳可将GGT分为四个区带。但目前认为控制GGT的基因位点只有一个,上述差异是由于酶蛋白中糖基组成不同而引起。
【组织分布】
人体各器官中GGT含量按下列顺序排列:肾、前列腺、胰、肝、脾、肠、脑等。大部分酶与细胞的膜结构结合,例如在肝细胞胆管侧的细胞膜上。虽然此酶在肾脏含量最高,学者相信血清中GGT主要来自肝脏。
【生理变异】
年龄与妊娠与否对GGT影响不大,不似ALP常明显升高,如同时测此二酶,有助于临床医师判断肝脏是否有病变。
男性血中GGT含量明显高于女性,可能与前列腺有丰富的GGT有关。酗酒会引起GGT明显升高,升高程度与饮酒量有关,诊断疾病时必须排除这一因素。
【标本的采集、处理和贮存】
GGT是一个比较稳定的酶,室温中2天、4℃放1周活性无变化,-20℃可储存1年,红细胞中GGT含量很低,溶血对本酶测定干扰不大。
【参考值范围】
以γ-谷氨酰-3-羧基-4-对硝基苯胺和双甘肽为底物的动态法,在37℃测定,成年男性的参考值为7-56U/L,成年女性为0-30U/L。
【临床应用】
GGT在疾病时的变化可参阅表7-8:
表7-8 γ-谷氨酰基转移酶在疾病时的变化
| 增高 | 无变化 | |
| 胆道疾病 | 明显增高,可达5-30倍正常上限 | 骨疾患 |
| (胆石症、炎症) | 阳性率高,为85%-93% | 妊娠 |
| 肝实质疾病(肝炎,肝硬化) | 轻度增高,可达2-5倍正常上限 | |
| 肝癌(原发,继发) | 明显增高且阳性率高 | |
| 诱导作用 | 轻度升高,停药后降至正常 | |
| (乙醇,苯巴比妥,抗抑郁药,抗癫痫药,含雌激素避孕药 |
GGT测定在我国临床应用很广,可能是因为我国肝脏疾病发病率高,而GGT又是肝胆疾病中阳性率最高的酶。德国内科学会通过对13000例肝胆患者调查,发现95%病例GGT升高,其次才是ALT,阳性率为83%,第三位是胆碱酯酶,如同时测此三种酶,阳性率可达99%。
胆道疾病如胆石症、胆道炎症、肝外梗阻时,GGT不仅阳性率高,而且升高明显,可高达正常上限的5-30倍,肝脏实质疾病如肝炎、脂肪肝、肝硬化时GGT一般只是中度升高(2-5倍),这点有助于肝胆疾病的鉴别诊断。
GGT又是诊断恶性肿瘤有无肝转移的一种很有用的试验,肿瘤患者如GGT升高常说明有肝转移可能。
当ALP升高时,同时测GGT有助于鉴别ALP的来源,如GGT正常说明此时ALP升高常来自肝外的器官,如骨骼疾病等。
临床在使用GGT时一定要注意它是一种诱导酶,不少药物能使血中GGT活性升高,如巴比妥类药物、抗癫痫的苯妥英钠、抗抑郁症的三环化合物、抗热解痛类的对乙酰氨基酚可引起GGT升高;抗凝药香豆素、含雌激素的避孕药以及治疗血脂升高的氯贝丁酯(法脂乙酯)都可引起GGT轻度升高。还有酗酒可使其升高,这些因素限制了此酶的应用价值。医师在应用此酶诊断疾病时,必须先除外这些非病理因素引起GGT增高的可能,国外有些国家由于酗酒人多,以致不测或少测此酶。
六、淀粉酶(AMY)及其同工酶
AMY对食物中多糖化合物的消化起着重要作用。作用于多种糖化合物,如淀粉、糖原等。它不同于植物中的β-淀粉酶,仅作用于多糖化合物的末端,α-淀粉酶可以随机作用于多糖化合物内部的α-1,4葡萄糖苷键,产生一系列分子不等的产物:糊精、麦芽四糖、麦芽三糖、麦芽糖和葡萄糖。
AMY是一种需钙的金属酶,其最适pH在6.5-7.5之间,卤素和其它阴离子有激活作用(Cl->Br->NO3->I-)。其分子量较小,约55ku,易由肾脏排出,尿中AMY活性浓度常高于血。
两个不同基因位点分别控制,并生成两种结构和抗原性有明显差异的AMY同工酶:一种由胰腺分泌,习惯上命名为胰腺淀粉酶(P-AMY);另一种主要来自唾液腺,常命名为唾液腺淀粉酶(S-AMY),但并不意味着只有唾液腺产生此种同工酶,其它器官如肺、骨、卵巢和甲状腺也能生成S-AMY。
【组织分布】
机体中胰腺含AMY最多,由腺泡细胞合成后通过胰管分泌入小肠,唾液腺也分泌大量AMY入口腔开始消化多糖化合物,此外AMY还见于卵巢、肺、睾丸、横纹肌和脂肪组织中,在某些肺癌和卵巢癌患者中可查到AMY升高,且主要为S-AMY,肝中AMY很少乃至没有。
【生理差异】
成年人血中AMY与性别、年龄、进食关系不大,新生儿AMY缺乏,满月后才出现此酶,逐步升高,约在5岁时达到成人水平,老年人AMY开始下降,约低25%。
尿AMY浓度由于受尿液浓缩或稀释的影响,随意留尿测定AMY的诊断价值受到一定限制,国外学者多建议留6小时或24小时尿液测其AMY总含量更为可靠。
【标本采集、处理和贮存】
有些实验室常用血浆作为标本测AMY,这样可以更快地报告结果。但由于AMY为需钙酶,大多数常用抗凝剂都将抑制AMY活性,还是以血清为标本较好。收集标本时必需注意避免唾液的污染,否则将引起假阳性。
AMY是一种很稳定的酶,室温中一周,4℃几个月酶活性都无变化。
【参考值范围】
国内大多数实验室仍使用苏木杰(Somogyi)的碘-淀粉呈色法,由于各实验室所用水解淀粉来源不同,不同实验室所测结果有所差异,但大多数血AMY都在200苏氏单位以下。
愈来愈多临床实验室使用人工合成基质,在自动生化分析仪上测定AMY,但目前尚无成熟的AMY推荐法,不同厂家出的试剂盒由于所用基质不同,结果很难一致,其参考值范围可参考各厂家说明书。
【临床应用】
临床上测定血清AMY主要用于诊断急性胰腺炎,此酶常在腹痛后2-12小时升高,20-30小时达到高峰,一般为正常上限值的4~6倍,最高可达40倍。此值的高低和疾病预后关系不大,但此值愈高,急性胰腺炎的可能性就愈大,约在3-4天内AMY活性恢复正常。急性胰腺炎时尿AMY也增高,且持续时间更长,但由于尿浓度还受尿液浓缩稀释影响,很难定出正常和病理界限,定时收尿测排泄AMY总量,结果虽较可靠但收集麻烦。国外学者认为测尿AMY诊断价值很小。临床医师有时要求测胸水或腹水中AMY活性,如显著升高说明此时急性胰腺炎病变累及胸、腹腔。
诊断急性胰腺炎时必需与其它急腹症相鉴别,可惜的是此时AMY也有不同程度升高,一般说来不超过正常上限的4倍或者500苏氏单位。此值常用作诊断急性胰腺炎的判断值,但也不是绝对的,个别急腹症患者AMY可超过此值,甚至达到2000苏氏单位。
唾液腺疾病如腮腺炎患者血AMY也可升高,但临床上不难鉴别,且主要为S-AMY升高,有别于胰腺炎以P-AMY升高为主。
国外报道在1%-2%人群中可出现巨淀粉酶血症,血中AMY和免疫球蛋白(IgG或IgA)形成大分子的复合物,临床化验特点为血中AMY持续升高,尿中AMY正常或下降。进一步检查可发现血中AMY分子量增高,此现象不和具体疾病有关,增高者也多无临床症状,注意应与病理性AMY升高相区分。
七、酸性磷酸酶(ACP)及其同工酶
酸性磷酸酶(ACP)是一组作用类似碱性磷酸酶的酶,不同点是最适pH偏酸,从pH4.5-7.0。
本酶生理作用还不十分清楚,主要存在于细胞的溶酶体中,是溶酶体的标记酶之一,推测此酶参加细胞中的分解代谢。
目前发现有4个不同的基因位点生成4类不同的同工酶,第一个基因位点生成前列腺ACP,其它组织仅有微量存在,有特异抗原性,用免疫学方法很易与其它ACP分开;第二个基因位点生成为溶酶体ACP,存在于细胞的溶酶体中;第三个基因位点生成为红细胞ACP,实际上不仅存在于红细胞中,还广泛存在于细胞质中;第四个基因位点生成ACP存在于破骨细胞和一些吞噬细胞,如肺泡的巨噬细胞,病理时还存在于高雪细胞和白血病的“毛细胞”中。
【组织分布】
它几乎存在于体内所有细胞中,虽然在细胞质中可找到ACP,但主要在于溶酶体,ACP主要组织来源是前列腺、红细胞和血小板。正常男性血清中1/3和1/2ACP来自前列腺,其余部分和女性血中ACP可能来自血小板或破骨细胞。
【生理变异】
男女性血中ACP含量无差异,新生儿ACP活性与成人相似,出生后1个月中血清酶活性甚高,然后随年龄的增长而逐渐下降,青春期又可出现一活性峰值,至20岁降至成人水平。
【标本的采集、处理和贮存】
常用抗凝剂抑制ACP活性,以血清为测定标本较好。
ACP是常用酶中最不稳定的一个,尤其在37℃和偏碱性时灭活更快,此时放置1小时,酶活性可丧失50%,如将pH降至6.5以下,酶比较稳定。最简单方法可按1ml血清加入10%醋酸20μl酸化,此时酶在常温可稳定1天,4℃3天,-20℃稳定几个月。
【参考值范围】
不同方法参考值也不同,国外多推荐使用磷酸麝香草酚为底物的方法,因为前列腺ACP对此底物亲合度高,测定结果基本能反映ACP含量高低,此法参考值范围为0.5-1.9U/L,男女无差异。
【临床应用】
主要用于论断前列腺癌,由于酶不稳定,测定困难,目前正被其它前列腺癌标记物如前列腺特异抗原(PSA)所取代。