第二节 发病机理
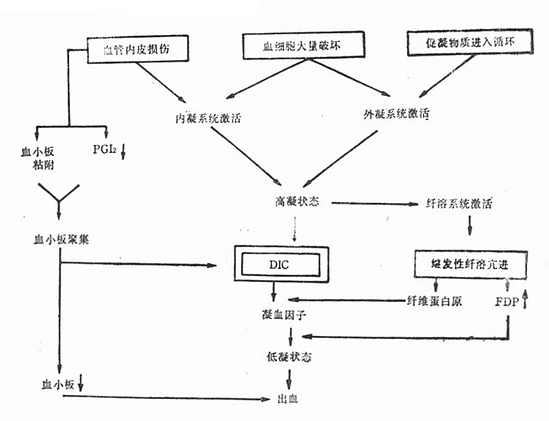
DIC的发病机理分下列四方面阐述(图42-1)。

图42-1 DIC发生机理
一、血管内皮损伤
细菌及其毒素、病毒及其代谢产物、抗原抗体复合物、长时间休克、缺氧及酸中毒等均可导致血管内皮损伤,使基底膜胶原纤维暴露,从而激活因子Ⅻ,继而启动内源性凝血系统;同时损伤的血管内皮可释放组织因子,激发外源性凝血系统。内、外源泉凝血系统激活的共同后果为循环内生成凝血酶,使纤维蛋白原变为纤维蛋白,即红色血栓,造成血管内凝血。此外,血管内皮广泛损伤使前列环素(PGI2)合成减少,有利于血小板聚集,形成白色血栓。
二、组织促凝物质及其他促凝物质进入循环
孕期宫腔内容物(羊水、胎盘组织、死胎等)、大量组织损伤(大面积烧伤、严重外伤及大手术等)所释放的组织因子均为强烈的组织促凝物质。肿瘤细胞、放疗及化疗后肿瘤或白血病细胞破坏时所释放的内容物,革兰阴性杆菌的内毒素及胰酶等均为促凝物质,具有组织因子的活性。上述物质都可启动外源性凝血系统。
三、血细胞大量损伤
各种原因引起的严重溶血(如血型不合的溶血性输血反应、药物过敏、自家免疫、溶血尿毒症综合征等),由于红细胞大量破坏释放红细胞素;血小板大量破坏(如急性血栓性血小板减少性紫癜、人工心脏瓣膜、药物过敏、自家免疫等)所释放的磷脂;白细胞大量破坏(如某些严重感染引起的急性粒细胞减少或缺乏)所释放的溶酶体酶。上述三种血细胞的释放物都具有强烈的促凝活性,可激活内、外源凝血系统。
四、继发性纤溶亢进
这是机体的一种保护性代偿机能。实际上在DIC初期就开始了纤溶过程。激活的因子Ⅻ、生成的凝血酶、纤维蛋白在血管壁的沉积,受损的组织或血管内皮细胞释放的纤溶酶原活化素等,都能使纤溶酶原变为纤溶酶。纤溶酶为一种蛋白分解酶,可溶解纤维蛋白。当纤溶酶浓度进一步增高时,也可溶解纤维蛋白原、因子Ⅴ、因子Ⅷ。纤维蛋白及纤维蛋白原经纤溶酶消化先后形成碎片X、Y、D、E,称之为纤维蛋白(原)降解产物(FDP)。FDP能干扰纤维蛋白单体的聚合,对抗凝血酶及影响凝血活酶的生成,干扰血小板聚集,故FDP具有强烈的抗凝作用。
继发性纤溶亢进加之大量凝血因子及血小板在DIC过程中的消耗,使血液由高凝状态逐渐转为低凝状态。
上述DIC的发病机理在一个具体病人中往往为多种原因、多种机制同时相互作用,其过程极为复杂。
下列因素常有利于DIC的发生、发展。①血浆凝血因子及血小板数增加:故孕妇分娩时易发生高凝状态,其中一部分孕妇如并发产科合并症则可导致DIC;②纤溶活性减低:如激素可抑制纤溶活性;③单核-巨噬细胞系统阻滞:长期应用肾上腺皮质激素、脾切除及肝功能障碍时该系统功能减低,循环中形成的纤维蛋白,进入循环的促凝物质及已被激活的凝血因子不能及时清除,易于发生血管内凝血;④血流淤滞:心力衰竭、应用α肾上腺能药物、巨大血管瘤等可使全身或局部血流淤滞,有利于血管内凝血的发生。