
第二节 高脂蛋白血症
高脂蛋白血症(hyperlipoproteinemia)指的是血清脂蛋白浓度升高。根据异常脂蛋白的表型,辅以其他方法对高脂蛋白血症进行分类。如将高脂蛋白血症分为原发性和继发性,继发性高脂蛋白血症是指由其他已知疾病引起的高脂蛋白血症;也分为遗传性的和非遗传性;还可根据脂蛋白组分含量的不同进行分类,如高VLDL胆固醇血症、高LDL胆固醇和高HDL胆固醇血症。
表10-1 继发性高脂蛋白血症的病因
表型 |
病因 |
| 高乳糜微粒血症 | 胰岛素依赖性糖尿病 异常球蛋白血症 盘状红斑狼疮 胰腺炎 |
| 高β脂蛋白血症 | 肾病综合症 胸腺机能减退 阻塞性肝病 卟啉尿 多发性骨髓瘤 门脉性肝硬变 急性病毒性肝炎 粘液性水肿 应激反应 神经性厌食 自发性高钙血症 |
甲状腺机能减退 异常r球蛋白血症 粘液性水肿 原发性胆硬变 糖尿病酸中毒 |
|
| 高前β脂蛋白血症 | 糖尿病 肾病综合症 妊娠 激素治疗(如口服避孕药) 糖原积累病 酒精中毒 高雪氏病 尼曼-皮克氏病 胰腺炎 甲状腺机能减退 异常球蛋白血症 |
| 混合型脂蛋白血症 | 胰岛素依赖性糖尿病 肾病综合症 酒精中毒 骨髓瘤 自发性高钙血症 胰腺炎 巨球蛋白血症 糖尿病(胰岛素非依赖型) |
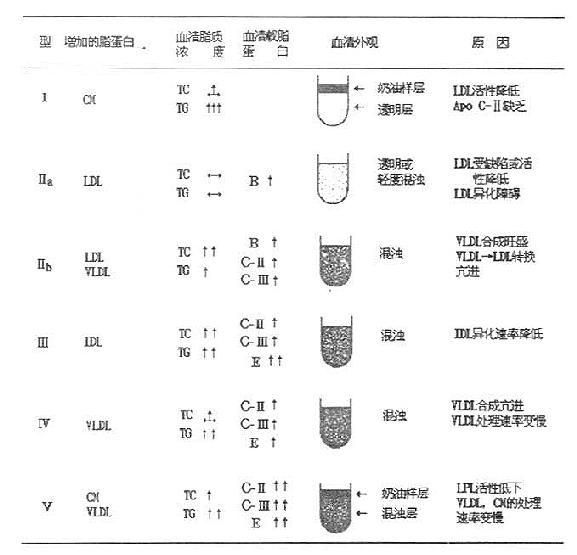
高脂蛋白血症的类型很多,但主要是遗传性高脂血症,共有六种常见异常脂蛋白类型,可用表10-1来概括。主要用四种脂蛋白系列中的三种即乳糜微粒、VLDL和LDL(包括IDL)作为依据来划分。Fredrickson表型分类系统没有考虑HDL和其他脂蛋白的重要性。最近世界范围的流行病学调查发现HDL胆固醇浓度与冠心病风险存在有统计上的负相关系。因此,测定LDL胆固醇和HDL胆固醇可从侧面反映血中脂蛋白的水平。
临床上,高脂蛋白血症的分类主要依靠血浆脂类及异常脂蛋白的电泳图谱,进行综合分类,如表10-2所示。每型的琼脂糖脂蛋白电泳分类图见图10-1。

图10-1 高脂血症的脂蛋白琼脂糖电泳图
表10-2 人高脂血症分型及其特征
一、高乳糜微粒血症
高乳糜微粒血症(hyperchylomicronemia)患者新鲜血清外观呈乳白色混浊,4℃冷藏过夜血清外观:上层因有乳糜微粒漂浮而呈现糜状,下层清亮透明状。本症为常染色体隐性遗传,家族遗传性纯合子型患者除血脂改变外,临床症状也明显。而杂合子患者,虽呈现高甘油三酯血症,但症状不显著。
因乳糜微粒含量增加的缘故,该型脂蛋白异常以高血甘油三酯浓度为特征,一般高于11.29mmol/L。因乳糜微粒也含胆固醇,其胆固醇随甘油三酯升高亦增加,LDL和HDL通常偏低,而VLDL可轻度增加。
由于肝外组织脂蛋白脂肪酶活性缺陷,从肠粘膜细胞输入血液中的乳糜微粒不能经脂肪组织进行正常的分解代谢,使血中乳糜微粒贮留。近年来从载脂蛋白的角度研究证实,此类患者ApoCⅡ含量不足,不能激活脂蛋白脂肪酶,为其主要病因。CM中TG不能水解转变成CM残粒,无法被LDL受体识别摄取进行代谢,从而造成CM在血液中堆积。
原发性高乳糜微粒血症常在儿童期发病。虽然这种脂蛋白异常常为原发性和家族性,但也可由几种其他疾病或代谢状态而引起。因此,应排除继发性脂蛋白异常的可能性(见表10-1)。
排除继发性原因后,原发性可根据如下表现进行证实:①脸黄疣、肝脾肿大、视网膜脂血、腹痛和早发胰腺炎;②服药可引起继发性高甘油三酯血症;③血浆甘油三酯脂酶活性降低;④无脂肪饮食甘油三酯降低和乳糜微粒消失;⑤家系分析证实为常染色体隐性遗传。
当今降脂药对降低血清甘油三酯无效,因此治疗这种异常症只能采用低脂肪饮食,因乳糜微粒随进食脂肪的消化而产生,治疗方法是将饮食脂肪降到占总能量消耗的10%,可在24h内降低血清甘油三酯,一般是先将血清甘油三酯降到11.29mmol/L以下,从而降低急性胰腺炎的发病风险。第二步再降至正常。一般推荐健康人甘油三酯水平<2.26mmol/L,如表10-3所示。
表10-3 NECP推荐甘油三酯风险分级
| 甘油三酯(mmol/L) | 风 险 |
<2.26 |
正 常 |
2.26~4.52 |
较 高 |
4.52~11.29 |
高 |
>11.29 |
很 高 |
二、高β脂蛋白血症
高β脂蛋白血症(hyperbetalipoproteinemia)的特点为血浆胆固醇浓度升高而甘油三酯大多正常,血清外观清晰属于Ⅱa型,又称为家族性高胆固醇血症,血清脂蛋白电泳呈现浓染的β-脂蛋白带,提示脂蛋白升高,故又称为高β脂蛋白血症。引起原发性高胆固醇血症的原因有:①VLDL产生过多;②VLDL转换成LDL速率增加;③LDL含胆固醇酯过多;④LDL结构缺陷;⑤每个细胞上LDL受体数量减少或活性降低。据估计约50%的胆固醇浓度改变是由遗传决定的,脂蛋白电泳图谱显示β-脂蛋白升高而前β-脂蛋白正常,该病有如下特征:①培养的成纤维细胞上有功能的LDL受体数量减少,此项具有确诊价值,具体有LDL受体缺乏、LDL受体缺陷和入胞缺陷三种表现;②婴儿呈现Ⅱ型表现;③严重者有黄色瘤;④30~40岁者,常见有早发冠心病。
胸腺机能减退、急性卟啉综合症、异常γ球蛋白血症、阻塞性肝病、高饱和脂肪和胆固醇饮食引起的继发性高β脂蛋白血症与原发性高β脂蛋白血症区分开来。原发性高β脂蛋白血症可用下面几条确证:①家系分析,包括儿童;②连续8周进低胆固醇(<300mg/日),高多不饱和脂肪酸饮食(多不饱和/饱和脂肪酸为1:1.2)后仍有顽固性高胆固醇血症;③腱黄瘤、黄色瘤和角膜弓的出现;④LDL受体缺乏或缺陷。
家族性高胆固醇血症(12.95~38.85mmol/L)需要特殊治疗。除了下面要提到的饮食疗法和药物疗法外,很多家族性高胆固醇血症病人要求每3~4周滤出血浆中的LDL。特别严重则应进行肝移植。对非家族性高胆固醇血症,第一步治疗是严格降低饮食脂肪。如没有效果,可用降脂药。
食物疗法的目的在于保持充足营养前提下降低血LDL胆固醇。NECP成人治疗小组推荐食物疗法分两步,病人体重过重时应降低总脂肪和饱和脂肪酸及胆固醇的摄入,降低体重,这一步是通过降血压、升HDL胆固醇、降低糖尿病发病率来降低冠心病发病率,第一步食物疗法开始4~6周后检测LDL胆固醇和HDL-胆固醇水平,3个月后继续监测。如降胆固醇目的未达到,病人应接受第二步疗法。
如食物疗法没有效果,应用药物治疗,降胆固醇药物包括胆酸多价螯合剂(消胆胺或Cholestipol);HMG-CoA还原酶抑制剂,如Lovastatin(Mevacor)、Prarastatin(Pravacol)、Simvastatin(Zocor)、Fluvastatin(Lescol)、烟酸和Probucol。药物降脂效果应在4~6周和3月进行监测。
三、复合性高脂蛋白血症
家族性复合性高脂蛋白血症(combined hyperlipoproteinemia)的特点有:①培养的患者成纤维细胞LDL受体数目正常;②儿童缺乏高β脂蛋白带;③很早即出现高甘油三酯血症;④患者家系连续几代出现多种脂蛋白异常图谱;⑤通常为高β脂蛋白且伴有高胆固醇血症,如图10-2所示。
复合性高脂蛋白血症最常见的原发性高脂蛋白血症之一。在一个家系内脂蛋白表型散在分布,病人的LDL和VLDL同时升高。同一个家族中,高β脂蛋白血症和前β脂蛋白血症可分别存在于不同病人中。复合性家族性高脂蛋白血症一般要到成年时才能发现。临床上,这种病人冠心病发病率增加,常伴糖尿病,有高尿酸血倾向,而肌腱炎和结节黄色瘤发病率相对较低。家族性复合高脂血症的遗传方式还未确定。

图10-2 家族性复合型高脂血症与高载脂蛋白
β-脂蛋白血症的脂蛋白代谢
ApoB异化正常,因VLDL的ApoB合成亢进,促使
LDL的ApoB再次合成增加
这种脂蛋白异常的特点是:总胆固醇、LDL、甘油三酯、VLDL等升高,有漂浮β脂蛋白出现。血浆电泳图谱中,除β-脂蛋白增高外,前β脂蛋白含量升高,但二者并不融合,又称为Ⅱb型高脂血症。Ⅱb型与Ⅱa型的主要区别是LDL受体活性正常,患者多合并肥胖,糖代谢及胰岛素分泌异常。Ⅱb型为显性遗传性疾患。本病VLDL合成量过多,ApoB100合成量比正常高两倍,LDL也增高,另外VLDL合成增加的同时,VLDL代谢分解速度并未增强,从而使过量合成的VLDL不能加速分解,造成血浆中VLDL蓄积,同时LDL代谢速度也减慢。在确诊本型原发性脂蛋白异常时必须排除继发性高胆固醇和高甘油三酯的病因,应进行家系分析,应了解影响甘油三酯的因素。人群调查研究表明,随着年龄增加,甘油三酯水平也增加,四分之一的中年男性的甘油三酯超过规定的极限值,这说明甘油三酯极限值虽有统计意义,但不能代表其生理极限。
在评估该型脂蛋白异常时,应考虑食物中碳水化合物的作用。据报道,高甘油三酯血症患者禁食后可因进食碳水化合物而产生本型的电泳图谱。因此,确诊复合性高脂蛋白血症不能象β脂蛋白血症或高前β脂蛋白血症一样仅用脂蛋白电泳即可确诊。下面要提到的宽β脂蛋白血症不再被认为是独特的和纯合子的家族性高胆固醇血症,而是由高浓度的Lp(α)或称“沉淀性”前β脂蛋白引起的,电泳图谱易与复合性高脂血症相混淆。
对复合性高脂蛋白血症的治疗应集中在降LDL-胆固醇和甘油三酯浓度。降LDL-胆固醇的方案在高β-脂蛋白血症中已详述。降甘油三酯和VLDL胆固醇稍有区别,先进行食物疗法,关键是碳水化合物和能量,要求限制乙醇、加强体育锻炼、控制体重。当病人有很高甘油三酯时需用药物治疗。降甘油三酯药物有安妥明和Gemfibrizol,它们同时可使VLDL和LDL胆固醇也随之降低。治疗复合性高脂血症的药物常选烟酸,它能有效降胆固醇(LDL胆固醇)和甘油三酯,同时升高HDL胆固醇。
四、异常β脂蛋白血症
异常β脂蛋白血症(dysbetalipoproteinemia),也称阔或宽β脂蛋白血症。主要特征是血浆胆固醇和甘油三酯升高、异常LDL(更确切地说是IDL处于密度<1.006g/ml组分中)。这种异常LDL常与前β带融合产生“阔β带”,因而出现β-移动度的VLDL,故又称为高β-VLDL血症。用超速离心法测量密度小于1.006g/ml组分的脂固醇和甘油三酯有助于异常β脂蛋白血症的确诊。
测定密度小于1.006g/ml组分的脂蛋白组成比单纯用电泳测定漂浮β脂蛋白来诊断异常β脂蛋白血症更可靠。临床上,当甘油三脂浓度在1.68mmol/L以上时,用血浆VLDL-胆固醇/甘油三酯来区分这种高脂蛋白血症,若甘油三酯超过11.29mmol/L时易出现错误的诊断。有主张以VLDL-胆固醇/甘油三酯≥0.3诊断为异常β脂蛋白血症;比值在0.25~0.29时为可疑,再用等电聚焦检测ApoE的E2~E3进行证实。该型又称为Ⅲ型高脂血症,属显性遗传。多见于ApoE2/E2型,LDL受体的结合能力仅是ApoE2/E3型的20%~40%。其代谢改变是:①β-VLDL经肝脏的ApoE受体清除受阻;②肝脏从CM残粒获得的外源性胆固醇减少,自身合成Ch并分泌VLDL增多,使VLDL过度生成而堆积于血浆;③LPL活性降低,VLDL在体外不能转变成LDL,Ⅲ型患者除β-VLDL出现外,Ch和TG均升高如图10-2所示,Ⅲ型比较罕见。
临床上,本病因年龄、性别和肥胖程度不同而表现不一。还与胸腺机能减退和酒精中毒有关。阔β脂蛋白血症引起的黄色瘤称为斑状黄瘤(xanthoma striatum palmare),这种桔黄色或黄色掌斑状黄色瘤是最轻微的损害,很容易发现。如进一步发展可产生旋涡状突起甚至掌纹消失和数字式皱折。轻者损伤存在于局部掌面,严重者产生结节,更甚者使手掌残废。
阔β脂蛋白血症与冠心病正相关,可用饮食疗法和药物疗法治疗。这种脂蛋白异常与心血管病的联系明显不同于其他家族性高β脂蛋白血症与心血管病的联系,本型对外周血管损害与心血管病的损害或冠心病一样多见。继发性阔β脂蛋白血症常由胸腺机能不全、痛风、糖尿病和急性肾功衰接受血液透析引起。
五、高前β脂蛋白血症
阔β脂蛋白血症(hyperprebetalipoproteinemia)也称内源性高脂血症或碳水化合物诱导的高脂血症,很多学者不再接受后一种说法,因碳水化合物诱导的高甘油三酯血症也可在正常脂代谢个体中出现。
根据甘油三酯浓度增加,总胆固醇正常或中度升高、血浆4℃静置10~12h没有乳糜微粒可对高前β脂蛋白症作出初步诊断属于Ⅳ型高脂蛋白血症或者称为高VLDL血症。电泳后有明显的前β脂蛋白带、浓染、增宽,而LDL胆固醇仍在正常范围,还可用生化指标用来证实高前β脂蛋白血症。确定高前β脂蛋白血症后,应进一步区分是原发性还是继发性的。
原发性高前β脂蛋白血症的诊断标准如下:①高前β脂蛋白的电泳图谱;②VLDL胆固醇升高;③一个或更多一级亲属有这种异常;④近亲没有其他原发性脂蛋白异常。
治疗方案在复合性高脂血症中已详述。
六、混合性高脂蛋白血症
电泳图谱呈现乳糜微粒及前β-脂蛋白染色带的浓染。属于高乳糜微粒和高前β脂蛋白二者都存在的混合型高脂蛋白血症(mixed Hyperlipoproteinemia),即Ⅴ型高脂血症。将患者血清置4℃冷藏10h后发现血清上层有漂浮的奶油盖状乳糜微粒层形成奶油盖,下层呈混浊状,属于罕见的血清外观。甘油三酯水平与高CM血症相似。血LDL-C和HDL-C低于正常,Ch在正常范围,VLDL-C超出正常范围,VLDL-C/VLDL-TG低于0.3。若给予患者注射肝素后,血清CM消失。与Ⅲ型不同点是Ⅴ型人血清VLDL-C/VLDL-TG在0.3以上。该型患者,若仅是LPL活性降低,属显性遗传;若既有LPL活性降低又有ApoCⅡ减少,则属于隐性遗传,常于20岁前发病,家族史明显的Ⅴ型者,丘疹状黄色瘤的发病率可高达30%~50%,并伴有急性胰腺炎和肝脾肿大。因ApoCⅡ缺乏,LPL活性降低,VLDL生成过多而代谢速率降低等原因导致VLDL在血浆中堆积。
这一类型脂蛋白异常,常见腹部症状,有胰腺炎、疹样黄色瘤、脂质肾炎、肝脾肿大。与高乳糜微粒血症相反,本型好发生于成年人,一般50~60岁发病,女性发病迟于男性。
` 此型也可由很多不同疾病、药物、饮食习惯等原因引起,故应仔细区分原发性和继发性。分析饮酒史,服用雌激素或固醇药物,进行尿液分析,检测禁食或餐后2h血糖和肝、甲状腺、肾功能均有助于区分原发性和继发性的诊断。
混合型高脂蛋白血症的生化缺陷仍不是很清楚。患者体内VLDL合成过剩,分解代谢迟缓,同时乳糜微粒分解代谢也缓慢,致使该型出现高CM血症与高VLDL血症混合存在。
唯一治疗高乳糜微粒的方法是低脂肪饮食。用限制饮食来减轻体重以治疗混合型高脂蛋白血症可取得很好疗效。也可用如下药物进行治疗:烟酸、novethindroml、oxandrolone、benzafibrate、gemfibrizol或clofibrate。
七、高HDL血症
有报道,血浆HDL含量过高导致高HDL血症,也属于病理状态,HDL具有抗动脉粥样硬化作用,是人们公认的,然而并非血浆HDL含量越高越好,血浆HDL-胆固醇(HDL-C)含量超过2.59mmol/dl定义为高HDL血症,现已查明,高HDL血症是因为有CETP和HTGL等活性异常所致,高HDL血症又分为原发性和继发性,原发性高HDL血症的病因有以下几种①CETP缺损;②HTGL活性降低;③以及其他不明原因。继发性高HDL血症病因有:运动失调;饮酒过量;④原发性胆汁性肝硬化;⑤治疗高脂血症的药物引起;⑥其他原因。总之,CETP及HTGL活性降低是引起高HDL血症主要的原因。CETP缺陷,HDL上的CE蓄积,使HDL增多;若HTGL活性降低,HTGL与HDL被肝细胞摄取并使HDL2→HDL3转换过程有关。HTGL活性降低使HDL被肝细胞摄取量减少而停留在血液中并使其浓度增加,出现高HDL血症。血清中总胆固醇轻度或中度升高,HDL-C高达正常人3~5倍的高值,血清ApoAⅠ、CⅢ,E明显增加,ApoB呈低值。CE量增加,因为CETP活性低,从HDL转运到含ApoB的脂蛋白的CE量减少,即运输障碍所致。高HDL血症多见于CETP缺乏者,易出现多分散LDL,而HDL颗粒变大,有实验表明,CETP活性低的动物作胆固醇负荷实验很容易形成动脉粥样硬化,对人而言,高HDL血症与动脉粥样硬化的关系有待进一步研究。
HDL按超速离心法可分为HDL2和HDL3,Blanche及Albers等报道,用聚丙烯酰胺梯度凝胶电泳可将HDL分为HDL1,2a,2b,3a,3b,3c六种亚组份颗粒,如图10-4所示。健康人HDL3c Stokes直径7.8nm;HDL3b为8.4mn;HDL3a为9.0mn,HDL2a为9.6nm和HDL2b为10.8nm。并报道冠心病患者大型颗粒HDL2b减少,小颗粒HDL3b增加,认为HDL2b的上升有抗动脉粥样硬化的作用,HDL3b颗粒的增加与动脉粥样硬化形成有关,进而推测高HDL3b血症中若是HDL3b组份增加者,则可以引起脂质代谢障碍。
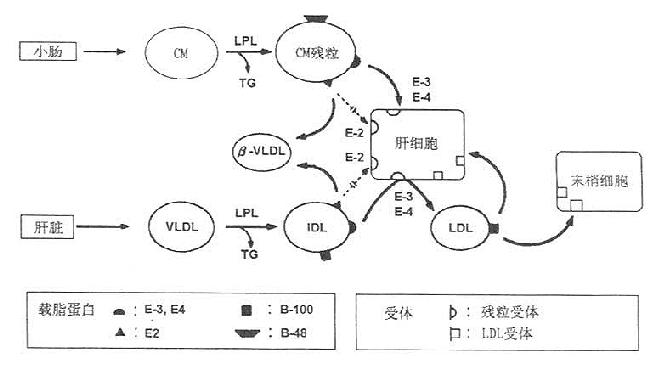
图10-3 富含TG脂蛋白的代谢与Ⅲ型高脂血症发病机制
近期有作者提出HDL-C与长寿的问题。Jeffery等于1996年报告的一例59岁的妇女,血胆固醇为9.1mmol/L,HDL-C为5.7mmol/L、LDL-C为2.8mmol/L,TC与HDL-C的比值为1.6(心血管病危险因素比值为5.0),ApoAⅠ含量超过正常对照者。该患者经其他有关的物理检查,未发现有任何动脉粥样硬化的征兆。将患者血浆ApoAⅠ提纯作体内的代谢研究提示,患者血浆ApoAⅠ的清除率是正常的,并诊断为高α-脂蛋白(HDL)血症。经家族史调查,该妇女父母亲及外祖父均为长寿者,尚未发现与脂代谢有关的疾患。
该例提示了长寿的遗传倾向问题。导致动脉粥样硬化形式的因素是多方面的,环境因素与遗传因素对其病理生理的过程具有重要影响。众所周知,环境因素与吸烟、饱和脂肪酸和食物胆固醇消耗以及营养过剩,均与症状性心血管病的发生有关。同样,基因变异所致的LDL-C极度增高HDL-C总量低下均可加速动脉粥样硬化的形成。1988年leaf报道百岁老人的共同特点是每日体力劳动和低饱和脂肪饮食。Schaefer等于1989年报导,80岁以上的长者均无血浆HDL-C含减少,并认为HDL-C与长寿有关。Gofman报导,提高HDL-C基因可以防止动脉粥样硬化的发生,为此提出,通过基因能否预防动脉粥样硬化的问题。流行病学研究表明HDL-C浓度愈高,发生心血管病的危险性愈低。根据Framingham的1988年的报道,HDL-C含量为1.5mmol/L或更高者,即使同时有HDL-C的增高,对心血管病的发生LDL-C仍属于阴性危险因素。此外,降低LDL-C浓度的干预试验提示,HDL-C可以提供相对的保护作用,LDL-C浓度降1%,可使心血管危险性降低2%;然而HDL-C浓度增加1%,则使心血管病发病率至少降低2%~3%。该研究表明,HDL-C对心血管疾病确实有预防作用。
临床已注意到HDL-C的预防作用。HDL的生理功能是通过HDL中各组份介导的。HDL的主要载脂蛋白是ApoAⅠ、AⅡ,ApoAⅠ在肝和肠内合成,ApoAⅡ仅在肝内合成。HDL中各不同密度的颗粒,其载脂蛋白组成是有差异的。含有AⅠ颗粒而不含AⅡ颗粒,称为脂蛋白AⅠ唯一颗粒,代号为Lp AⅠ-Only particles,该颗粒可以防止心血管疾病。其他各种蛋白质,也可影响HDL颗粒的成份和代谢,LCAT和HL是HDL中脂质代谢调节中心,CTP在该颗粒核心内,以TG从易致粥样硬化的含有ApoB的脂蛋白中交换胆固醇酯。血小板活化因子酰转移酶能使HDL和LDL中的磷脂生成具有生物活性的溶血磷脂酰胆碱及小板活化因子(PAF)。还有系列活性代谢酶,可以保护HDL的脂质受氧化性损伤,从而增强HDL对心脏的保护功能。
目前所知,HDL-C浓度升高有三种遗传原因。其一是遗传性ApoAⅠ基因过度表达;其二是家族性高α脂蛋白血症,这两种遗传因素导致HDL-C浓度升高,ApoAⅠ含量增加,使心血管发病率降低;其三是CTP基因突变,使胆固醇酯在血浆脂蛋白中与甘油三酯交换能力降低,进而导致HDL-C浓度增高。有报导,CTP缺乏的纯合子个体,HDL-C浓度可超过3.9mmol/L,与此相反,在ApoAⅠ产生过多的患者,HDL浓度过高则是HDL从血液循环中清除过缓所致。然而HDL浓度增高可防止早发性心血管病,还有待证实。
HDL可以通过不同的机理发挥作用。它能影响血管舒缩力或诱导内皮细胞增殖,有助于动脉壁对抗内皮下组织直接暴露于血循环所致的损伤;HDL又能缓冲LDL的氧化;HDL能清除自由基保护LDL免遭氧化的损害。HDL可清除细胞内过多的胆固醇,以减少粥样硬化斑的形成。其中的ApoAⅠ基因过表达可使HDL-C浓度增加并减弱粥样化的发展。ApoAⅠ基因可能是一种杂交基因(Methuselah genes),该基因可以改变动脉粥样硬化的慢性病的多种遗传因子的性状。ApoAⅠ基因过度表达能降低心血管疾病发病率的事实,指示可以通过基因传递技术的使用,使人们可以采用各种杂交基因治疗甚至预防心脑血管性疾病。
Fredrickson于1963年将高脂蛋白血症分为六型,在临床诊治疾病过程中有一定的意义,然而从临床实验室诊断方法学考虑,作脂蛋白检测有一定难度,电泳分离法欠准确,按超速离心法,操作时间过长,难以快速定量。另外,高脂蛋白血症多数与遗传有关,目前可采用载脂蛋白基因分型。载脂蛋白的基因分型是目前研究脂质代谢及探讨动脉粥样硬化发病机制的热门话题。
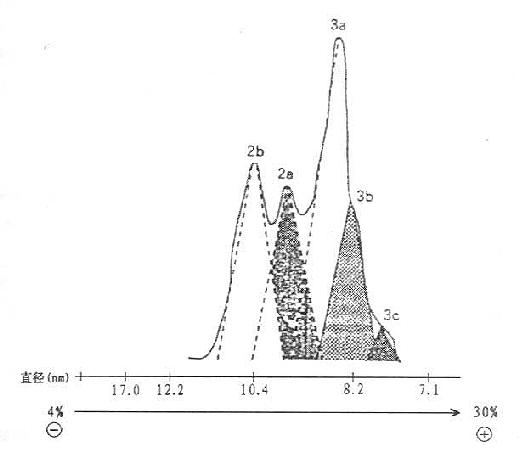
图10-4 健康人HDL亚组份颗粒的聚丙烯酰胺梯度(4%~30%PAG)电泳图
(源自:Blanche,P.J.et al B.B.A,1981)