第六节 自由基与细胞凋亡
细胞凋亡(apoptosis)是细胞的主动死亡,它参与机体许多生理和病理过程,并起着调节作用。
一、细胞凋亡
细胞凋亡是Kerr等于1972年首先提出的一种不同于细胞坏死的细胞死亡方式,它具有特征性形态和生化改变,是细胞自身主动死亡的过程,又称为程序性细胞死亡(programmed cell death, PCD),生命体内细胞死亡有两种完全不同的形式,当细胞遭受急性和严重损害时,细胞肿胀破裂,胞液外溢导致周围组织发生炎症,即坏死过程。细胞在正常死亡时,出现细胞收缩,细胞核成片状,电镜可见到细胞膜上有很多的小泡生成。DNA电泳区带呈梯状,这种方式称为细胞凋亡。细胞凋亡是指细胞在生理和病理情况下的一种死亡模式,参与胚胎发育及变形胸腺细胞的克隆选择、细胞介导的细胞毒作用、衰老造血细胞的清除、肿瘤发生、人类免疫缺陷、病毒感染及化学治疗等。因此,对细胞凋亡的研究成为免疫学、细胞生物学、肿瘤学和分子生物学等领域的热门课题。
二、细胞凋亡与自由基作用的关系
众所周知,氧化还原反应是人体内最为广泛和重要的化学反应,自由基尤其是活性氧(reactive oxygen species, ROS)及其衍生物自由基是氧化反应中的重要成分。ROS与衰老密切相关,而衰老细胞的死亡实质上就是细胞凋亡。
目前,研究较多的肿瘤坏死因子(tumor necrosis factor, TNF)是由巨噬细胞和单核细胞产生,激活TNF受体可使细胞内ROS明显增加。体外试验表明TNF能诱导细胞凋亡,细胞对TNF的敏感性还与SOD的降低有关,如缺乏SOD的T细胞对TNF、电离辐射和高温引起的细胞凋亡更敏感。
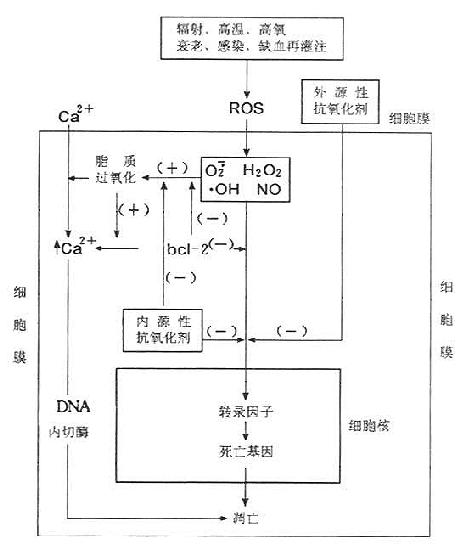
据报道,能引起细胞氧化的因素均能引起细胞凋亡。电离辐射和紫外线照射能通过直接攻击水分子而在水中产生·OH,并能诱导细胞凋亡,如图9-10所示。H2O2在体内Fe2+分子反应生成超氧阴离子O2-和H2O2,通过对巨噬细胞和单核细胞的研究,Albina等提出NO也是细胞凋亡的诱导剂。抗肿瘤药物如阿霉素和顺铂等虽然本身不是自由基,但是它们可以引起ROS的增加;而另一种药物如Bathionine Sulfoxamine等则能消耗细胞内GSH,两类抗肿瘤药物能使细胞对多种因素诱导的细胞凋亡更敏感。

图9-10 氧化诱导细胞凋亡的机制及其调节
(源自:陆怡等生物化学与生物物理进展.23(2))
现已报道,有25个癌基因与细胞凋亡有关。与自由基尤其是氧化关系最密切的是bcl-2基因,bcl-2基因是人类发现的第一个死亡抑制基因。已证实,bcl-2基因表达能抑制多种因素(电离辐射、高温、GSH合成抑制剂、生长因子缺乏)引起的细胞凋亡,其机制不清,Kane等报导,bcl-2的表达并不能增加细胞SOD活性,可能是通过阻断电子传递链中ROS的产生,或者起了ROS清除剂的作用而调节细胞的氧化还原状态,从而调节细胞凋亡。
三、细胞凋亡相关基因
细胞凋亡相关基因大致可分为两大类,即凋亡促进(apoptosis on)基因和凋亡抑制(apoptosis off )基因。它们分别起着促进凋亡和抑制凋亡的作用,彼此之间还存在一定的相互关联。
1.凋亡促进基因
凋亡促进基因有ced-3,4、p53、ICE、Bax、bcl-Xs、TGFβ等。其中ced-3,4是在线虫索中发现的,而p53、ICE等存在于哺乳动物中。p53为肿瘤的抑制基因,分为两型,一型是使细胞周期停止在GI期,抑制细胞繁殖的野生型;另一型是具有突变能力的变异型。野生型p53可诱导易感细胞发生凋亡。白介素1β转换酶(interlukin 1-β-converting enzyme, ICE),与线虫细胞凋亡相关基因ced-3有较高的同源性,具有直接诱导细胞凋亡的作用。Bax和bcl-Xs均为bcl-2基因家族成员,两者可结合形成二聚体或异体二聚体,两者之间的比例决定了细胞的命运。若Bax占多数,则bcl-2被抑制,诱导细胞死亡;反之,则Bax受到抑制,细胞得以生存。
2.凋亡抑制基因
凋亡抑制基因包括bcl-2、ced-9、bcl-X,其中最主要也是当前研究最多的是bcl-2,bcl-2是癌基因的一种,在人体多种形态的肿瘤中过度表达,可抑制由多种剌激包括化疗和放疗引起的细胞凋亡。bcl-2常在淋巴细胞系统(胸腺、脾、淋巴结)和神经系统(右脑、中脑,小脑)中表达,抑制该部位的细胞凋亡。淋巴性白血病细胞中bcl-2也是过度表达的。Bcl-X1也是bcl-2家族成员,是由bcl-X编码的两种不同bcl-XmRNA而产生。bcl-X1有抑制神经细胞凋亡的作用。
四、细胞凋亡与脂质代谢紊乱的关系
Forrest等[3]发现H2O2诱导的细胞凋亡中,让H2O2作用于细胞膜两h后,用膜保护剂Trolox(VitE类似物)能阻止细胞凋亡的发生。由于ROS很容易与膜的多聚不饱和脂肪酸(PUFA)和胆固醇反应,引起氧化链式反应,因此膜脂质过氧化以后才有DNA损伤、细胞损害。最近Isabelle等[5]报道,氧化低密度脂蛋白(OxLDL)可诱导细胞凋亡。
自由基尤其是ROS具有很强的生物活性,很容易与生物大分子反应,直接损害或者通过一系列过氧化链式反应而引起广泛的生物结构的破坏。为了减少有氧代谢过程中自由基对细胞的损害,细胞内有一系列有效的抗氧化防御机制,包括清除ROS的SOD、过氧化氢酶(CAT),谷胱甘肽过氧化物酶(GSHPX)、硫氧还原蛋白(phioredoxin)等和阻断过氧化链式反应的生育酚、胡罗卜素和抗坏血酸等。通常细胞处于氧化与抗氧化平衡中而维持着正常的功能。一旦氧化与抗氧化作用失衡,细胞的功能将会受到影响,细胞凋亡可能就是这种失衡的结局之一。
(周翔 郑芳)
参 考 文 献
1.周新,自由基及其对机体作用,见:徐学峰主编,生理生化学与医学(第二版),北京:科学出版社,1987年,504-515
2.周新,红细胞代谢的某些进展,见:生物科学参考资料(第七集)。北京:科学出版社,1977,23-41
3.周新,超氧化物歧化酶化与活性氧,国外医学分子生物学分册,1980,2:84-89
4.惠宏襄,赵小宁,金明,等,自由基与细胞凋亡,生物化学与生物物理进展,1996,23:12-16
5.陆怡,潘华珍,许彩民,氧化与细胞凋亡,生物化学与生理进展,1996,23:118-121
6.Southorn PA,Powis G,Free radicals in Medicne Ⅱ,Involvement in Human Disease Mayo Clin Proc,1988,63:390-408
7.Mitchel JD,et al.Cu/Zu Superoxide dismutase ,free radicals ,and motor neurone disease .Lancet ,1993,342:1051-1054
8.Fecondo JV,Auqusteyn R,Superoxide dismutase ,catalase and glutathione peroxidase in the human cetaractous lens.Exp Eye Res,1983,36:15-23
9.Halliwell B,et al.Free radicals and human disease where are we now J.Lab Clin Med,1992,119-:598-620
10.Leff JA,et al .Serum antioxidants as predictors of adult tespiratory distress sgndrome in patients with sepsis,Lancet ,1993,341:777-780
11.Rimm EB,et al .Vitamin E consumption and the risk of coronary heart disease in men New Eng J Med ,1993,328:450-456
12.Witztum JL,Steinberg D.Role of low density lipoprotein in atherogenesis .J Clin Invest,1991,88:1785-1792
13,Neve J.et al Usual values for selenium and glutathione peroxidase in a belgian poprlation .Am Biol Chem,1989,47:138-143
14.Block G.A role for antioxidants in reducing cancer risk .Nutr Rev,1992,50:207-213
15.Cerutti PA.Oxy radicals and cancer .Lancet ,1994,344:862-863.
16.Stampfer M,et al.Vitamin E consumption and the risk of coronary disease in women.New Eng J Med ,1993:1444-19449
17.Petersen RC,Smith,G,Irnik RJ,et al .Apolipoprtein E statrs as a predictor of the derelopment of Alzheimer’s disease in memory impaired indiveduals JAMA,1995,273:1274-1278