第四节 氧化低密度脂蛋白
天然的低密度脂蛋白(LDL)经氧化修饰形成的脂蛋白,称为氧化低密度脂蛋白(OxLDL)。天然LDL核心的脂肪酸中含有大量不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)约占LDL总脂肪酸含量的35%~70%,所以容易发生自身氧化。
LDL中的PUFAs在自由基或其他氧化剂作用下,生成脂类自由基,并能产生更多的过氧化脂质,引起连锁的自由基链式反应,最终生成多种反应性的醛。这些化学性质活泼的醛和ApoB发生结合,产生新的抗原决定簇,形成氧化LDL。OxLDL与动脉粥样硬化关系密切。
一、修饰的LDL与巨噬细胞泡沫化
从动脉粥样硬化发病机制,我们不难发现LDL在动脉粥样硬化发生、发展中起非常重要的作用。
(一)内皮细胞俘获LDL和巨噬细胞泡沫化
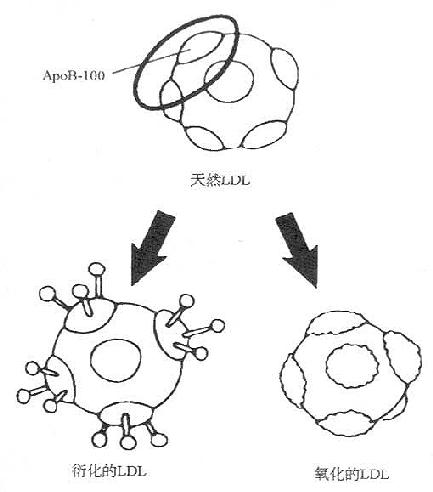
高脂血症、脂质代谢失常是动脉粥样硬化的重要病因。血浆中增多的脂质以LDL的形式经完整的内膜侵入内皮下,这一过程呈现LDL浓度依赖性,无需受体介导。另有观点认为,机械因子、化学因子、免疫因子、毒素或感染因子对内皮的损伤,导致LDL-胆固醇摄取增多。这又反过来会改变内皮细胞和循环血细胞(单核细胞、血小板)的表面特性,促进单核细胞粘附于血管内皮,并转变为巨噬细胞,转变后的巨噬细胞更有能力摄取更多的脂质,在内皮下被俘获的天然的LDL可以经历两种形式的修饰,即衍化和氧化,如图9-6所示。

图9-6 LDL的修饰在内皮下间隙,被俘获的天然的LDL可能经历两种形式的修饰-衍化(MAD粘附于ApoB-100或者ApoB-100的糖基化)、氧化(ApoB-100被过氧化物降解),分别形成衍化的LDL和氧化的LDL。
天然LDL在正常情况下,由LDL受体识别。LDL和LDL受体结合后,内吞入细胞,与溶酶体结合。在溶酶体酶的作用下,蛋白质降解为氨基酸,胆固醇酯水解为游离胆固醇和脂肪酸。此受体受到细胞内胆固醇含量的下降调节,当细胞内胆固醇的含量增多时,LDL受体的量便会减少。所以,天然LDL经这一途径代谢,不会引起胆固醇酯在细胞内堆积。
LDL还可以通过清道夫受体途径代谢。这一受体主要参与修饰的LDL的代谢,没有下降调节的特点,不受细胞内胆固醇的含量的应答。通过此途径,修饰LDL被摄取和降解的速度都比正常LDL快。所以LDL这一代谢途径直接参与动脉粥样硬化中泡沫细胞的形成,如图9-7所示。
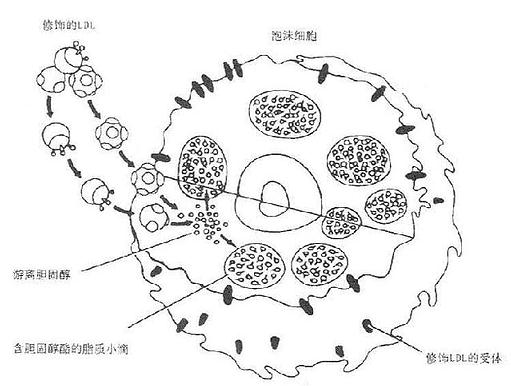
图9-7 泡沫细胞的形成巨噬细胞通过修饰LDL受体途径摄取(消化)修饰的LDL。导致大量的负荷脂质的小滴进入,泡沫细胞的形成是动脉粥样硬化进程中脂肪纹形成的标志。
(二)LDL的氧化修饰
1.LDL氧化修饰的形式
(1)细胞介导的LDL氧化修饰
1981年,Henriksen等人将兔主动脉内皮细胞和LDL孵育一段时间后,发现该LDL被巨噬细胞摄取的速度较未与内皮细胞共同孵育的LDL快,而且在孵育的基质中发现了硫代巴比妥酸反应物(TBARS),据此,认为内皮细胞可以氧化修饰LDL。这是细胞介导的LDL氧化修饰,又称生物氧化修饰的LDL。后来发现除内皮细胞外,巨噬细胞、血管内膜平滑肌细胞、单核细胞都可以氧化修饰LDL。
(2)过度金属离子介导的LDL氧化修饰
过度金属离子Ca2+、Fe2+等,在体外适宜条件下与LDL孵育一段时间后,也能使LDL发生氧化变构。因为这是利用化学物质氧化LDL,故称为化学氧化修饰的LDL。
(3)其他形式的氧化修饰
还可以使用物理学方法如紫外线、钴60对LDL进行氧化修饰。利用过氧化酶类也可能使LDL转变成OxLDL。
2.氧化修饰的过程
LDL的氧化可人为划分为三个阶段。最初为迟滞阶段,消耗内源性抗氧化剂(VitE);增殖阶段,PUFAs快速氧化为脂质氢过氧化物;分解阶段,脂质氢过氧化物转变为反庆性的醛。这些醛包括丙二醛(MDA)、4-羟烯酸(4-HNE)等,并可以和ApoB发生共价结合(主要和ApoB的赖氨酸残基结合),形成新的抗原决定簇。OxLDL丧失与天然LDL受体结合的能力,被清道夫受体所识别。
3.氧化修饰后LDL理化的生物学特性
OxLDL不同于天然LDL。OxLDL内维生素E含量下降,游离氨基减少,琼脂糖电泳速率增快。LDL中所含的大量卵磷脂转变为溶血卵磷脂。氧化修饰程度低时,ApoB以分解为主。修饰程度高时,降解的ApoB又可重新聚合成大分子。氧化LDL还具有一系列生物学毒性作用。氧化修饰后的LDL不能经LDL受体代谢,由清道夫受体识别、结合、内吞饮入细胞并丧失正常的胆固醇代谢途径,引起细胞内脂质沉积,泡沫样变。
4.修饰的LDL和氧化修饰的LDL的区别和联系
氧化的LDL是修饰LDL中的一类。修饰的LDL除包括氧化修饰的LDL外,还包括乙酰化LDL及丙二醛、4-羟烯酸直接结合的LDL,我们称这些未经氧化修饰,而仅经一般化学修饰的LDL为衍化的LDL。
衍化的LDL和OxLDL都可以被清道夫受体识别,导致泡沫细胞的形成。在过去的很长一段时间里,我们将一般化学修饰的衍化的LDL和OxLDL混为一谈。特别是认为氧化LDL就是MDA-LDL。但实际上,MDA-LDL不同于OxLDL。
用Ca2+引发LDL的氧化修饰,比较氧化修饰的LDL与脂质过氧化降解产物MDA修饰的LDL之间的差别。发现氧化修饰LDL和MDA修饰LDL都产生类似于脂褐质的荧光物质,都可使LDL上的游离氨基减少,琼脂糖电泳速度加快,且游离氨基减少量与电泳迁移率增加呈正相关。但两类不同的修饰LDL之间也有差异,主要表现在:①对细胞生理功能影响不同。氧化LDL可诱发细胞毒性作用,影响花生四烯酸的代谢,抑制胆固醇酯化作用等,而一般化学修饰的LDL则无上述效应;②氧化修饰消耗LDL内源性抗氧化物质,使LDL上的维生素E含量下降,而MDA修饰无上述改变;③氧化修饰涉及脂质过氧化反应,LDL中的PUFAs被氧化。MDA对LDL修饰,是直接和ApoB-100结合成希夫氏碱,脂质过氧化反应轻微;④氧化LDL在氧化程度低时,ApoB降解,在氧化程度高时,ApoB又可发生再聚合。MDA对LDL的修饰,ApoB无降解、聚合反应发生;⑤氧化LDL产生的荧光峰波长为430nm,而MDA修饰LDL的荧光峰波长为460nm。这些差异可能是由于两类不同的修饰对LDL结构与组成影响不同,提示我们不能简单地把脂质过氧化降解产物修饰的LDL等同于OxLDL。
二、氧化LDL的代谢
OxLDL由清道夫受体识别并进一步代谢。清道夫受体可能是多种受体的总称,据报道,除乙酰化LDL的受体外,Fcr受体和CD36受体也能介导OxLDL的摄取和降解。现已证实分离纯化的清道夫受体是由3个λkD的亚单位构成的糖蛋白,存在于细胞表面,聚丙烯酰胺凝胶电泳测得分子量为2.2×105左右。清道夫受体可以和乙酰化LDL、OxLDL以及诸如次黄嘌呤核苷酸、丝氨酸磷脂等配体结合。这些物质的共同特点为多阴离子化合物。正常LDL受体是通过识别ApoB上由赖氨酸、精氨酸、组氨酸共同构成的正电荷区与LDL结合的。LDL氧化后,产生的反应性醛和LDL的ApoB的赖氨酸残基的ε氨基结合,使LDL失去一些正电荷,带上多量负电荷。这样OxLDL不能再被LDL受体识别,而被清道夫受体结合。而且OxLDL摄入速度是天然LDL的3~10倍,并且不受细胞内胆固醇含量的应答。
巨噬细胞和内皮细胞对不同氧化程度的LDL的结合和降解量是不同的。总的来说,随着氧化修饰程度的升高,巨噬细胞和内皮细胞对LDL的结合和降解随之升高。将LDL与Ca2+孵育,LDL经氧化后得到琼脂糖迁移率(Rf)分别为1.33、1.67、2.33的氧化LDL。研究巨噬细胞和内皮细胞对这几种不同氧化程度的LDL的结合和降解,发现当LDL修饰程度很低(Rf=1.33)时,OxLDL被巨噬细胞结合和降解的量接近、甚至低于天然LDL,而当修饰程度高时,被巨噬细胞和内皮细胞结合和降解的量随之升高,而且明显高于正常LDL(图9-8、图9-9、图9-10、图9-11)。
另有报道,正常细胞摄取OxLDL时,LDL受体与清道夫受体起协同作用。因为氧化程度不同。OxLDL的ApoB上可能残留多少不等的LDL受体识别位点。用单抗封闭这些位点时,细胞对OxLDL结合量和降解量下降。
三、OxLDL存在的可能性
(一)动脉粥样硬化损伤灶存在OxLDL
有学者发现人、兔动脉粥样硬化斑块处分离出的LDL的特性与OxLDL相似,包括电泳速度加快、ApoB降解等。而正常动脉壁处LDL无此特性。
最近,生产出的针对MDA-ApoB的单克隆抗体和MDA-VLDL、MDA-HDL、MDA-白蛋白不发生交叉反应。利用特异性抗原抗体反应推测来源于冠心病人的组织标本,发现在平滑肌细胞、巨噬细胞来源的泡沫细胞中和斑块核心脂质中都有免疫反应发生,而且在人、兔的动脉粥样硬化病灶区存在抗OxLDL的自身抗体。
(二)血浆中是否存在OxLDL
抗MDA-LDL自身抗体的滴度可用来预测冠状动脉粥样硬化进展。然而这些抗体和蛋白质(如蛋白)中MDA-赖氨酸加合物发生交叉反应。目前,尚没有血浆中存在OxLDL的直接证据,血浆中存在脂质过氧化物和TBARS,它们的含量可以用脂质TBARS荧光微量测定法测量。它们可能是氧化LDL的裂解片段。
有学者制备抗OxLDL的单抗,推测血浆中OxLDL的含量,并通过临床试验证实冠心病患者血浆中OxLDL浓度高于正常人。然而,由于血浆中是否存在OxLDL有待证实,故这种检测方法是否能够用于动脉粥样硬化的辅助诊断有待证实。
四、OxLDL与动脉粥样硬化
OxLDL可以通过以下途径促进动脉粥样硬化的发生、发展。
(一)参与泡沫细胞的形成
在早期的动脉粥样硬化损伤中,发现负荷脂质的泡沫细胞在动脉内膜下集聚。这些泡沫细胞主要来源于摄取OxLDL的单核/巨噬细胞。内皮下泡沫细胞的堆积在动脉粥硬化起因中有关键作用。
Marilee Loughecd等认为氧化LDL能抵抗组蛋白酶,从而抵抗溶酶体对OxLDL的降解,在细胞内堆积。当然,细胞内胆固醇量对清道夫受体的非下降调节是细胞泡沫化的主导原因。这些泡沫细胞以大量的二级溶酶体和胞浆脂滴为特点。脂质在泡沫细胞中沉积的结果使得动脉壁从最初的脂肪纹发展到更复杂的纤维斑块和粥样斑块。这些斑块最外层富含巨噬细胞来源的泡沫细胞,易于发生斑块破裂,引起血栓形成。
(二)促进细胞粘附和巨噬细胞源性泡沫细胞的产生
1.促进单核细胞的粘附和泡沫细胞的产生
单核细胞对动脉内皮粘附的增多是实验动物动脉粥样硬化早期表现之一。氧化LDL可以通过剌激细胞间粘附分子-1(ICAM-1)表达,使单核细胞,中性白细胞和淋巴细胞与内皮结合的数量增多,而且这种结合表现出高亲和力。还可以剌激内皮白细胞粘附分子-1(VCAM-Ⅰ)的表达,导致单核细胞的粘附移行。而且,OxLDL还能促使内皮细胞和血小板产生一种分子量为140kDa的颗粒膜蛋白(GMP140)。这种颗粒膜蛋白能在细胞激活的基础上快速翻译到细胞膜上,结合中性白细胞和单核细胞。微氧化的LDL,不能被清道夫受体识别,但它已能剌激特定的单核细胞粘附分子的表达。
单核细胞粘附于内皮后移行入内膜。内皮细胞、平滑肌细胞和巨噬细胞分泌特定趋化剂,如单核细胞趋化剂1(MCP-1),MCP-1的合成受OxLDL的剌激。
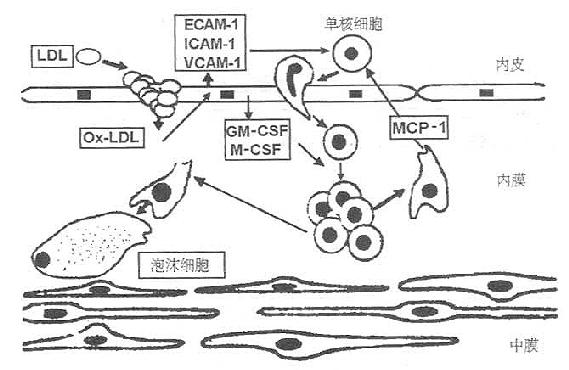
图9-8 单核细胞源泡沫细胞的产生
ECAM-1,内皮白细胞粘附分子-1 1CAM-1,细胞间粘附分子-1
VCAM-1,血管细胞粘附分子-1MCP-1,单核细胞趋化蛋白-1
M-CSF,单核细胞集落剌激因子 GM-CSF,粒细胞-单核细胞集落剌激因子
氧化LDL剌激内皮细胞分泌粘附分子(ECAM-1、ICAM-1、VCAM-1),内膜单核细胞的增生受特定集落刺激因子(GM-CSF、M-CSF)的诱导。继而单核细胞分化为巨噬细胞并分泌特异的针对单核细胞的趋化剂(MCP-1)。进而,巨噬细胞通过清道夫受体聚积OxLDL,转变为泡沫细胞。
OxLDL激活内皮细胞,促使趋化因子、粘附分子、粒细胞一单核细胞集落剌激因子(GMCSF)和单核细胞集落剌激因子(M-CSF)分泌。所有这一切都会剌激巨噬细胞的增生和分化。M-CSF诱导巨噬细胞表面清道夫受体的表达,使OxLDL摄取增多,巨噬细胞泡沫化(图9-8)。
2.促进中性白细胞粘附
研究发现注射OxLDL,可在体外诱导内皮结合白细胞,Lehr等人进一步证实这一作用涉及血小板活性因子受体和CD11b/CD18粘附受体复合物。
(三)诱导平滑肌细胞增生、移行,产生平滑肌细胞源性泡沫细胞
OxLDL通过诱导巨噬细胞和平滑肌细胞产生血小板源生长因子(PDGF),促进平滑肌细胞移行。通过诱导内皮细胞产生碱性成纤维细胞生长因子(bFGF),促进平滑肌细胞增生。最终,OxLDL诱导平滑肌细胞表面清道夫受体的表达,导致平滑肌细胞内吞OxLDL,继而产生平滑肌源性泡沫细胞(图9-9)。
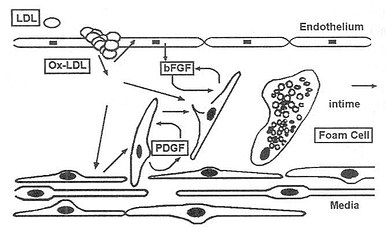
图9-9 平滑肌细胞源泡沫细胞的产生
bFGF,碱性成纤维细胞生长因子
PDGF,血小板源生长因子
OxLDL引起平滑肌细胞从中膜移行入内膜,结果内膜增厚。激活平滑肌细胞和巨噬细胞分泌PDGF和bFGF,它们可诱导平滑肌细胞增生和移行。而且bFGF诱导清道夫受体表达。通过这些受体,平滑肌细胞聚积OxLDL,转变成泡沫细胞。
(四)促进血小板粘附、聚集、血栓形成
OxLDL抑制内皮细胞衍生的舒张因子(EDRF)或NO的合成,损伤动脉壁正常的舒张功能。而且OxLDL中的溶血卵磷脂诱导合成内皮细胞衍生的收缩因子(EDCF),诱使血管收缩。
氧化LDL可以促使血小板聚集、增强花生四烯酸代谢及血栓素B2(TXB2)的产生,减少膜脂流动性。OxLDL抑制前列腺素I2合成酶,使前列腺素I2(PGI2)合成减少,激活血小板环氧化酶,使血栓素A2(TXA2)产生增加,破坏了PGI2/TXA2平衡,促进血小板聚集,引起血管痉挛和血栓形成。
(五)损伤内皮细胞
内皮细胞的损伤和功能改变是动脉粥样硬化发生的基础。内皮细胞的损伤在动脉粥样硬化的发病机理中作为起始机制,被认为具有重要作用。多种研究提示内皮细胞对自由基和脂质过氧化作用非常敏感。
LDL氧化过程中产生的脂氢过氧化物可以直接损伤内皮细胞。OxLDL可使内皮细胞对LDL的通透性增高,胞浆发生空泡变性,浆膜皱缩,甚至可使细胞最终坏死。内皮细胞受损又使内皮细胞保护剂PGI2的合成进一步减少,促进中性粒细胞对内皮的粘着及呼吸爆发,促进血小板在内皮聚集、释放O2-,进一步加重内皮损伤。
OxLDL对细胞的毒性无需受体介导。细胞对OxLDL的易感性取决于细胞分裂所处的细胞周期和细胞内谷胱甘肽的含量。丙丁酚可转移并渗入细胞膜作为一种捕捉自由基的抗氧化剂对抗氧化压力。细胞和OxLDL孵育会使基质中TBARS增多。这以上二点似乎提示内皮细胞膜自由基反应特别是脂质过氧化,与OxLDL激发的内皮细胞损伤有关。内皮细胞膜脂质过氧化降低膜脂质流动性,增加膜对离子渗透性,抑制膜结合酶活性。OxLDL怎样诱导细胞膜脂质过氧化,还不清楚。
(六)产生抗OxLDL的自身抗体
在兔和人的血清中都发现了抗OxLDL的自身抗体,且抗体的滴度和心血管动脉粥样硬化进程密切相关,表明免疫机制在动脉粥样硬化发病机理中起了作用。
最近还发现粥样斑块区的炎性浸润物包含T淋巴细胞和B淋巴细胞。这些T淋巴细胞主要是由局部抗原激活的淋巴细胞。斑块区沉积的胆固醇还能通过诱导人类主要组织相容性Ⅱ类抗原表达,加强巨噬细胞呈递抗原的功能。
OxLDL通过以上多种途径在动脉粥样硬化的起始和进展中发挥了举足轻重的作用。
既然OxLDL和动脉粥样硬化的关系如此密切,那么抗LDL的氧化修饰就成为阻断动脉粥样硬化进程的关键环节。有可靠的证据表明LDL的氧化修饰,只有在LDL内源性、亲脂性抗氧化剂消耗殆尽后才会发生,其中维生素E作为第一线抗氧化剂,β-胡罗卜素作为抗LDL氧化的最后一层屏障。如果的确是这样,就可以解释摄食的抗氧化剂的血浆水平为什么和心血管疾病的危险性呈负相关。流行病学研究也进一步表明血浆中维生素E水平高的人群,心血管疾病患病的危险性低。这些研究给动脉粥样硬化的预防和治疗提供了新的思路。