
第二节 脂质代谢
一、脂肪酸代谢
(一)脂肪酸(fattycaid)的分解代谢-脂肪动员
动物将脂肪酸以甘油三酯的形式贮存在脂肪组织内。一旦机体需要时,脂肪酶即可逐步水解甘油三酯为游离脂肪酸(freefat acid, FFA)及甘油并释放入血以供其他组织氧化利用,这一过程称为脂肪动员。调节这一过程的关键酶为激素敏感性甘油三酯脂肪酶。当禁食、饥饿或交感神经兴奋时,肾上腺素、去甲肾上腺素、胰高血糖素等分泌增加,作用于脂肪细胞膜表面受体,激活腺苷酸环化酶,促进cAMP合成,激活cAMP-蛋白激酶,使胞液内甘油三酯脂及的调控敏感,故称为激素敏感性脂肪酶。
脂肪分解成游离脂肪酸和甘油后进入血。血浆白蛋白具有结合游离脂肪酸的能力,脂肪酸不溶于水,与白蛋白结合后由血流运送至全身各组织,主要由心、肝、骨骼肌等摄取利用。甘油溶于水,直接由血液运送至肝、肾、肠等组织。在肝甘油激酶(glycerokinase)作用下,转变为α-磷酸甘油,然后脱氢生成磷酸二羟丙酮,循糖代谢径而代谢。
(二)脂肪酸的β-氧化
脂肪酸是人及哺乳动物的主要能源物质。供能方式是通过β-氧化,在O2供给充足的条件下,脂肪酸在体内被分解成CO2和H2O并释放出大量能量以ATP形式供机体利用。除脑组织外,大多数组织均能氧化脂肪酸,但以肝和肌肉最为活跃。脂肪酸氧化的亚细胞器是线粒体,而脂肪酸是不能自由通过其内膜的。因此脂肪酸在进入线粒体之前必然被活化和转载。
1.脂肪酸的活化-脂酰CoA的生成。
在ATP、CoASH、Mg2+存在下,脂酰CoA合成酶(acyl-CoAsynthetase)催化脂肪酸活化,生成脂酰CoA。

2.脂酰CoA进入线粒体
在线粒体内膜两侧有肉毒碱脂酰转移酶(carnitine acyltransferase)Ⅰ和Ⅱ,该酶促进脂酰CoA将脂酰基转移到肉毒碱生成脂酰肉毒碱.后者与载体结合进入线粒体内侧,在内侧由肉毒碱脂酰转移酶Ⅱ催化脂酰肉毒碱转变为脂酰CoA并释放肉毒碱。
3.脂肪酸的β-氧化
在线粒体基质中疏松结合的脂肪酸β-氧化多酶复合体的催化下,从酯酰基的β-碳原子开始进行脱氢,加水,再脱氢及硫解等四步连续反应,脂酰基断裂生成-分子比原来少两个碳原子的脂酰CoA和-分子乙酰CoA。
4.脂肪酸氧化的能量生成
体内能量的重要来源之一是脂肪酸的氧化。以软脂酸为例,进行7次β-氧化,生成7分子FADH2,7分子NADH+H+及8分子酰CoA。每分子FADH2通过呼吸链氧化产生2分子ATP,每分子ANDH+H+氧化产生3分子ATP,每分子乙酰CoA通过三羧酸循环氧化产生12分子ATP。因此一分子软脂肪酸彻底氧化共生成(7×2)+(7×3)+(8×12)=131ATP。减去脂酸活化时耗去的2个高能磷酸键,相当于2个,ATP净生成129分子ATP或129×30.5=3935KJ/mol。软脂酸在体外彻底氧化成CO2及H2O时的自由能为971KJ。故其能量利用率为:
3935/9791×100%=40%
5.脂肪酸的其他氧化方式
除β-氧化之外,机体还存在脂肪酸氧化的其他方式:①不饱和脂肪酸的氧化。不饱和脂肪酸也在线粒体中进行β-氧化,所不同的是饱和脂肪素β-氧化过程中产生的脂肪烯酰CoA是反式△2脂烯酰CoA,而天然不饱和脂肪酸中的双键均为顺式。因此,需经线粒体特异的△3顺→△2反脂烯酰CoA异构酶的催化,将△3顺式转变为β-氧化酶系所需的△2反式构型,然后沿β-氧化途径进行代谢。②过氧化酶体脂肪酸氧化,除线粒体外,过氧化酶体中亦存在脂肪酸β-氧化酶系,它能使极长链脂肪酸氧化成较短链脂肪酸,而对较短链脂肪酸无效;在脂肪酸氧化酶(FAD为辅基)催化下,脱下的氢不与呼吸链偶联产生ATP而是生成H2O2,后者为过氧化氢酶分解;③丙酸的氧化,人体含有极少量奇数碳原子脂肪酸,β-氧化后除生成乙酰CoA外,最终生成丙酰CoA。另外,支链氨基酸氧化亦可产生丙酰CoA。丙酰CoA经β-羧化及异构酶的作用可转变为琥珀酰CoA,然后参加三羧酸循环而被氧化。
6.酮体的生成及利用
酮体是乙酰乙酸(acetoacetate),β-羟丁酸(β-hydroxybatyrate)及丙酮(acetone)三者的统称。酮体是脂肪酸在肝分解氧化时特有的中间代谢物,因为只有肝具有合成酮体的酶系,但缺乏利用酮体的酶系。
酮体的利用,除肝外,肝外心、肾、脑及骨骼肌线粒体是较高活性的利用酶。其一是琥珀酰CoA转硫酶,催化乙酸转变为乙酰乙酰CoA,其二是乙酰乙酰CoA硫解酶催化乙酰乙酰CoA生成乙酰CoA,后者即可进入三羧酸循环而被氧化供能。其三是乙酰乙酸硫激酶,此酶可直接活化乙酰乙酸生成乙酰乙酰CoA,后者在硫解酶的作用下硫解为2分子乙酰CoA。
另外,β-羟基丁酸在β-羟丁酸脱氢酶的催化下,脱氢生成乙酰乙酸,然后循上述途径代谢。而丙酮不能按上述方式活化,除随尿排出外,在血中酮体剧烈升高时,可从肺直接呼出,总之,肝是生成酮体的器官,但不能利用酮体,而肝外组织不能生成酮体,却可利用酮体。
(三)脂肪酸的合成代谢
长链脂肪酸以乙酰CoA为原料在胞液内由不同于β-氧化的脂肪酸合成酶及多功能酶等催化而完成。
1.脂肪酸合成酶系及反应过程
在乙酸CoA羟化酶的作用下,乙酰CoA羧化成丙二酸单酰CoA。
ATP+HCO3-+乙酰CoA→丙二酰CoA+ADP+Pi
在多酶体系或多功能酶的作用下,乙酰CoA与丙乙酰开始重复加成过程,每次延长二个碳原子。十六碳软酯酸的生成,需经过连续的七步重复加成。
脂肪酸生物合成,从乙酰CoA合成丁酰-S-ACP为第一轮反应,七步反应分别有七种酶催化。①乙酰CoA羧化酶;②乙酰基-ACP转移酶;③丙二酸单酰基-ACP转移酶;④3-酮酰基-合成酶;⑤3-酮酰基-ACP还原酶;⑥3-羧酰基-ACP脱水酶;⑦3-烯酰基-ACP还原酶。七种酶催化完成七步反应最后生成丁酰-SACP。需指出的是在大肠杆菌中七种酶蛋白聚合在一起构成多酶体系,而高等动物,这七种酶活性都在一条多肽链上,属多功能酶。
脂肪酸生物合成的碳链延伸循环过程是每轮新生成的酰基-SACP再与丙二酸单酰-SACP缩合,经还原、脱水和还原诸反应延伸两个碳原子,这样每轮循环,加上两个碳原子。所以软脂酸经七次循环即生成。
2,不饱和脂肪酸的合成
人体所含的不饱和脂肪酸主要有软油酸、油酸、亚油酸、亚麻酸及花生四烯酸等。前两种可由人体自身合成,而后三种则必须从食物摄取,因为人体缺乏相应的去饱和酶。
去饱和酶位于动物体内组织内质网上,其催化脱氢过程已基本明了。此氧化脱氢过程有线粒体外电子传递系统参与。该系统在有机毒物氧化或苯环上加氧等机体解毒过程中,也有重要作用。例如去饱和酶能使硬脂酸(18:0)脱去2H成油酸(18:1,△9)。
3.脂肪酸合成的调节
脂肪酸合成主要受二方面的调节:一是代谢物的调节作用。进食高脂肪食物以后或饥饿会使脂肪动员加强,肝细胞内脂酰CoA增多,可别构抑制乙酰CoA羧化酶,从而抑制体内脂肪酸的合成;进食糖类使糖代谢加强。NADPH及乙酰CoA供应增多,有利于脂肪酸的合成,同时糖代谢加强使细胞内ATP增多,可抑制异柠檬酸脱氢酶,造成异柠檬酸及柠檬酸堆积,透出线粒体,可别构激活乙酰CoA羧化酶,使脂肪酸合成增加,此外,大量进食糖类也能增加各种合成脂肪有关的酶活性从而使脂肪合成增强;二是激素的调节作用。胰岛素是调节脂肪合成的主要激素,它能诱导乙酶羟化酶,脂肪酸合成酶乃至ATP-柠檬酸裂解酶等的合成,从而促进脂肪酸合成。胰岛素还能促进脂肪酸合成磷脂酸。胰高血糖素,肾上腺素、生长素则与胰岛素作用相反,通过抑制乙酰CoA羧化酶的活性,从而阻止脂肪酸的合成。
二、多不饱和脂肪酸的重要衍生物-前列腺素、血栓烷及白三烯
前列腺素(prostglandins,PG)最早发现于精液,现知前列激腺素来源广泛,种类繁多,但均为二十碳多不饱和脂肪酸的衍生物。血栓烷(thromboxane,TX)来自白细胞,是由二十碳多不饱和脂肪酸的衍生物,来自血小板。白三烯(leukotrienes,LT)来自白细胞,是由二十碳多不饱和和脂肪酸衍生而来。PG、TXA2及LT3几乎参予了所有细胞代谢活动,并且与炎症、免疫、过敏、心血管病等重要病理过程有关,在调节细胞代谢上亦具有重要作用。
(一)前列腺素(PG)、血栓烷(TX)及白三烯(LT)的合成
1.PG及TX的合成。
以花生四烯酸为原料,机体除红细胞外,其他各组织均有合成PG的酶系。血小板内还有血栓烷合成酶。当细胞受外界剌激如血管紧张素Ⅱ(agniotensionⅡ)、缓激肽(bradydinin)、肾上腺素、凝血酶及某些抗原抗体复合物或一些病理因子(许多激活因素尚未清楚),细胞膜中磷脂酶被激活,使磷脂水解释出花生四烯酸,在一系列的作用下,逐步合成PG和TX,其合成过程如图1-1所示。
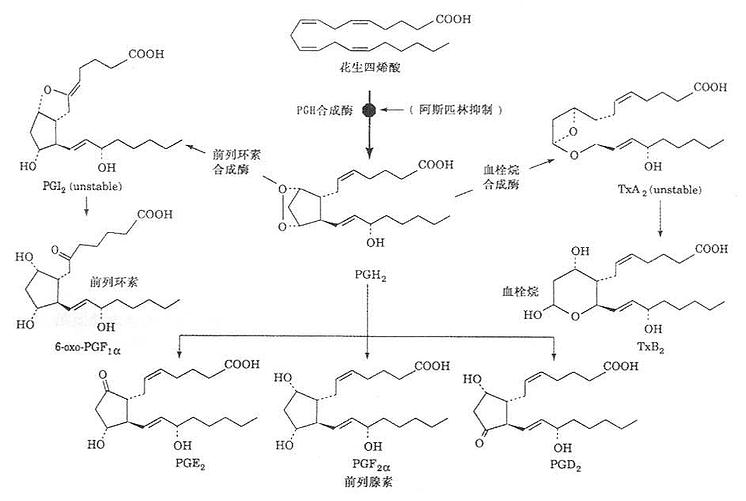
图1-1PG和TX合成示意图
2.白三烯的合成
白三烯合成同样以花生四烯酸为原料,在脂氧合酶(lipoxygenase)作用下,生成氢过氧化二十四烯酸(5-HPETE),后者在脱水酶作用下生成白三烯(LTA4)。LTA4在酶促作用下转变成具有重要生物活性的化合物,如LTB4、LTC4、LTD4、及LTE4等。如图1-2所示。
(二)血栓烷(TX),内过氧化物与环前列腺素(PGI2)
这两种物质是与前列腺素有密切联系的化合物。血栓烷A2(TXA2)由血小板内血栓烷合成酶催化合成。由于是首先在血小板内分离出而且分子内含有一个血栓烷,故名。血栓烷B2(TXB2)和6-酮基前列腺素F1a是TXA2和PGI2的降解产物,无生物活性。环前列腺素(PGI2)含有二个五碳环。故名,它是在人类动脉及静脉最里面的内衬处合成(包括冠状动脉内衬),由环前列腺素合成酶催化。
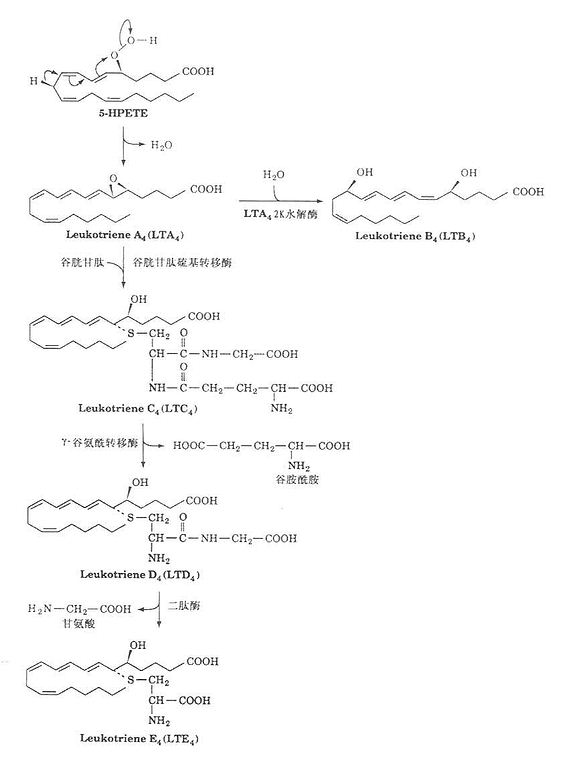
图1-2 白三烯合成示意图
三、胆固醇代谢
(一)胆固醇(clolesterol)的消化吸收
胆固醇主要由机体自身合成,但亦从食物中少量摄取。胆固醇主要来自动物内脏、蛋黄、奶油、肉等动物性食品,植物性食品不含胆固醇,但含植物固醇,过多摄入植物固醇可抑制胆固醇的吸收。食物中胆固醇以游离胆固醇和胆固醇酯两种形式存在,其中游离胆固醇占总量的85%~90%。胆固醇酯经胆汁酸盐乳化后,在小肠中为胰胆固醇酯酶水解生成游离胆固醇。游离胆固醇与胆汁酸盐,磷脂及脂肪的水解产物甘油一酯、脂酸等结合成混合微团,为小肠粘膜吸收。吸收的游离胆固醇80%~90%在肠粘膜细胞内,又与长链脂酸(主要是油酸)结合成胆固醇酯,后者大部分参入乳糜微粒(chylomicrons,CM),少量参与组成极低密度脂蛋白(verylowdensity lipoprotein, VLDL)经淋巴进入血循环。未被吸收的胆固醇在小肠下段及结肠被细菌还原转化为类固醇随粪便排出。
胆固醇的消化吸收可以由以下因素影响:①胆汁酸盐,它促进脂类包括胆固醇及固醇酯的乳化,既有利于胰脂酶及胆固醇酯酶及胆固醇酯酶的作用,又有利于胆固醇的吸收;②食物脂肪,脂肪能促进胆汁分泌,其分解产物又是混合微团的重要成份,它还促进肠粘膜细胞合成乳糜微粒,故食物脂肪有利于胆固醇的吸收;③植物固醇,由于其结构与胆固醇相似,但不易吸收,摄入过多可抑制胆固醇的吸收;④纤维素、果酸可与胆汁酯盐结合而促进其粪便排出,间接减少胆固醇的吸收;⑤某些药物如消胆胺,系阴离子交换树脂,它可与胆汁酸盐结合,加速胆汁酸盐的排泄,间接减少胆固醇的吸收。
(二)胆固醇的合成
1.合成部位
胆固醇合成部位除成年动物脑组织及成熟红细胞外,几乎在全身各组织内都可合成。但肝是主要合成场所,占合成总量的70%~80%。胆固醇合成酶系存在于胞液及光面内质网膜上,因此胆固醇的合成主要在胞液及内质网中进行。
2.合成过程
胆固醇合成部位以乙酰CoA为原料,而乙酰CoA主要产生于线粒体内,它不能自由通过线粒体内膜,需在线粒体内先与草酰乙酸缩合成柠檬酸,后者再通过线粒体内膜的载体进入胞液,然后在柠檬酸裂解酶的作用下,裂解生成乙酰CoA。这一过程是耗能的,每转支1分子乙酰CoA,要耗去1分子ATP。由乙酰CoA合成胆固醇需要大量的NADPH+H+及ATP供给合成反应所需的氢和能量。每合成1分子胆固醇需18分子乙酰CoA,36分子ATP及16分子NADPH+H+。乙酰CoA及ATP大多来自线粒体中糖的有氧氢化,而NADPH则主要来自胞液中糖的磷酸戊糖代谢途径。胆固醇合成步骤十分复杂,有近30步酶促反应大致可划分为三个阶段:
(1)甲羟戊酸的合成。在乙酰乙酰硫解酶的催化下,二分子乙酰CoA缩合成乙酰乙酰CoA;然后在羟甲基戊二酸单酰CoA合成酶(3-hydroxy-3-methylglutarylCoA Synthase,HMG CoA Synthase)的催化下再与一分子乙酰CoA缩合生成痉甲基戊二酸单酰CoA(3-hydroxy-3methylglutarylCoA,HMGCoA)。HMGCoA是合成胆固醇及酮体的重要中间产物。在线粒体中,三分子乙酰CoA缩合成的HMGCoA裂解后生成酮体;而在胞液中生成的HMGCoA则在内质网HMGCoA还原酶(HMGCoA reductase )的催化下,由NADPH+H+供氢,还原生成甲痉戊酸(mevalonicacid ,MVA)。HMG CoA还原酶是合成胆固醇的限速酶,该步也是胆固醇合成的限速反应。
(2)鲨烯的合成。MVA(C6)由ATP提供能量,在胞液内一系列酶的催化下,脱羧、磷酸化生成活泼的异戊烯焦磷酸(△3-isopenterylpyrophosphate, IPP)和二甲基丙烯焦磷酸(3,3-dimetytlallypyrophosphate ,DPP)然后三分子活泼的5C焦磷酸化合物(IPP及DPP)缩合成15C的焦磷酸法呢酯(farnesylpyrophosfhate, EPP)。二分子15C焦磷酸法呢酯在内质网鲨烯合酶(squalenesynthase)的作用下,再缩合,还原即生成30C的多烯烃-鲨烯(squalene)。
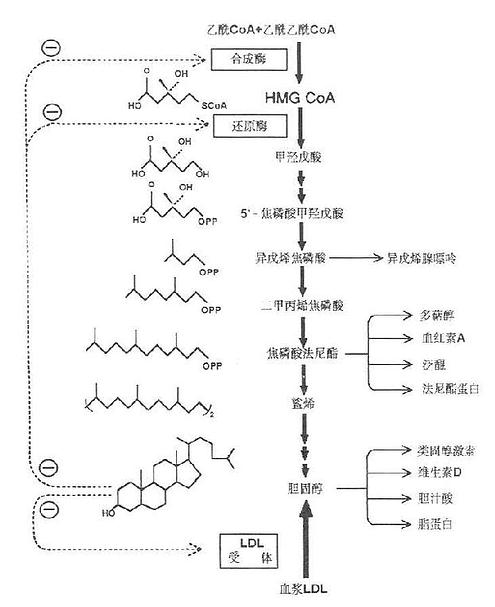
图1-3 胆固醇合成代谢图
(3)胆固醇的合成。鲨烯为含30个碳原子的多烯烃,具有与固醇母相近似的结构。鲨烯结合在胞液中固醇载体蛋白(sterolcarrier protein,SCP)上以内质网单加氧酶和环化酶等的作用,环化生成羊毛固醇,后者再烃经氧化,脱羧,还原等反应,脱云个甲基(次CO2形式后成27℃的胆固醇,如图1-3所示。
3.合成调节
对胆固醇合成的调节主要是通过对HMGCoA还原酶活性的影响来实现的。
(1)饥饿与饱食。饥饿与禁食可抑制肝合成胆固醇。禁食使HMGCoA还原酶合成减少活性降低外,乙酰CoA,ATP,NADPH+H+的不足也是胆固醇合成减少的重要原因。相反摄取高糖、高饱和脂肪膳食后,肝HMGCoA还原酶活性增加,胆固醇的合成增加。
(2)胆固醇。它可反馈抑制肝胆固醇合成,主要是HMGCoA还原酶的合成。如图1-3所示。
(3)激素。胰岛素及甲状腺素能诱导肝HMGCoA还原酶的合成,从而加速胆固醇的合成。胰高血糖素及皮质醇则能抑制则能抑制并降低HMGCoA还原酶的活性,因而减少胆固醇的合成。甲状腺素除能促进HMGCoA还原酶的合成外,同时又促进胆固醇在肝转变为胆汁酸,且后一作用较前者强,结果使血清胆固醇含量反而下降。
另外,胆固醇合成有明显的昼夜节律性。午夜时合成最高,而中午合成最低,主要是肝HMGCoA还原酶活性有昼夜节律性所致。
(三)胆固醇的转化
1.在肝内转化成肝汁酸
正常人每天约合成1.0-1.5g胆固醇,其中约2/5(0.4-0.6g)在肝内转变成胆汁酸,随胆汁排入肠道。胆固醇在肝实质细胞的内质网7α羟化酶作用下,由NADPH+H+供氢,O2参加,7α-羟化生成7α-羟胆固醇。7α-羟化酶属单加氧酶系,是胆汁酸合成的限速酶。7α-羟胆固醇在内质网3α-及12α-羟化酶的作用下,亦需NADPH+H+及O2参加,3α-及12α-羟化,然后17β侧链经β-氧化脱去丙酰CoA即形成24C的胆酸。仅3α和7α-羟则生成鹅脱氧胆酸。二者再在肝细胞酶的催化下,分别与甘氨酸及牛磺酸结合即形成结合型的甘氨胆酸,牛磺胆酸,甘氨鹅脱氧胆酸及牛磺鹅脱氧胆酸。结合型的胆汁酸分泌入毛细胆管经胆管随胆汁排入胆囊储存或排入肠道。胆汁酸可反馈抑制7α-羟化酶从而抑制胆汁酸的合成。结合型的初级胆汁酸随胆汁分泌入肠道后,在小肠下段及大肠中受细菌的作用,发生水解,生成游离型的胆汁酸随胆汁分泌入肠道细菌作用下,使7α羟基脱氧,胆酸转变为7-脱氧胆酸(7-deoxy cholic acid)鹅脱氧胆酸转变为石胆酸( lithocholic acid)。在肠道细菌作用后生成的7-脱氧胆酸及石胆酸即次级胆汁酸。
胆汁酸排入肠腔后,大部分未经细菌作用的结合型胆汁酸(甘氨胆酸及牛磺胆酸)在小肠,主要是回肠,通过主动吸收经门静脉回到肝,经肠道细胞作用后的游离型次级胆汁酸在大肠通过被动扩散进入门静脉。然后进入肝。肝细胞将从肠道来的游离型次级胆汁酸转变为结合型初级胆汁酸,与新合成的结合型胆汁酸一起,再分泌入毛细血管,经胆道又排入肠腔,这一过程称为肠肝循环。每次由肝排入肠腔的胆汁酸95%以上均被重吸收再利用,仅小部分随粪便排出。
胆汁酸生理作用是促进脂类的消化吸收。由于胆汁酸分子具有亲水和疏水的两个侧面,是一种很好的乳化剂,能使疏水的酯类在水中乳化成细小的微团,既有利于消化酶的作用,又促进其吸收。另外,还可阻止胆固醇在胆汁中形成结石(沉淀)。胆固醇难溶于水,胆汁在胆囊中浓缩后胆固醇较易析出沉淀。而胆汁酸盐卵磷酯,可使胆固醇分散形成成可溶性微团,使之不易形成结晶。若胆汁中胆固醇浓度过高或胆汁中酸盐及卵类脂与胆固醇的比值降低(小于10:1),则胆固醇析出沉淀,引起结石。
2.胆固醇在肝外组织的转化
胆固醇是肾上腺皮质、睾丸、卵巢等内分泌腺合成类固醇激素的原料。合成类固醇激素是胆固醇在体内代谢的重要途径。
(1)肾上腺皮质激素的合成。肾上腺皮质的球状带、束状带及网状带分别能够合成醛固酮、皮质醇(酮)、性激素。胆固醇是合成这些激素的原料。胆固醇在皮质细胞线粒体内膜的20α-羟化酶,22β-羟化酶及20,22碳链裂解酶的作用下,断裂侧链、释出一分子异已醛(6C),生成21碳的孕烯醇酮,羟化反应需NADPH+H+及O2参加。然后孕烯醇酮输出线粒体,在内质网异构酶的催化下,脱氢异构化生成21的碳的孕酮。孕酮是合成皮质激素的重要中间物,本身也具有激素活性,孕酮在17α、21β、11β及18羟化后,即可合成不同的皮质激素。
(2)睾丸酮的合成。睾丸间质细胞可直接以血胆固醇为原料合成睾丸酮。在17α-羟化酶及17,20碳裂解酸的作用下,胆固醇转化睾丸酮。

(3)雌性激素的合成。睾丸酮是卵巢合成雌二醇的直接前体。卵巢独有19-羟化酶,19-氧化酶及10,19碳裂解酶,在NADPH+H+及O2的参加下,睾丸酮的19位甲基氧化,三环芳香化转变为苯环,形成雌二醇。雌二醇的生理活性最大,雌酮(estrone)及雌三醇(estriol)为其代谢产物。
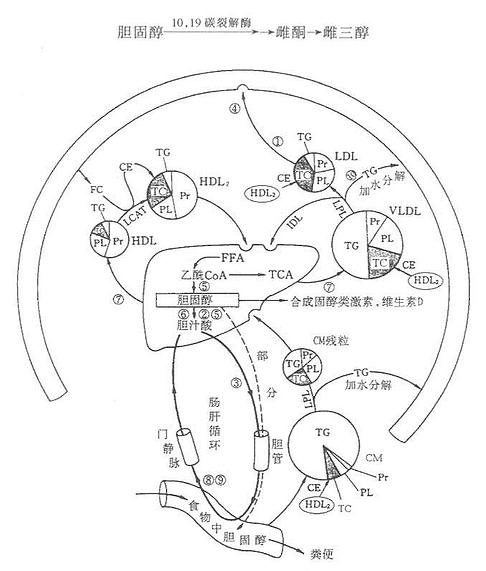
图1-4 胆固醇的主要代谢途径
胆固醇代谢与其他脂质代谢密切相关,是脂蛋白代谢的一个组成部分。血清胆固醇水平高低反映了机体某些脏器的代谢障碍,如血清胆固醇升高的有关疾病有:①糖尿病(LDL)代谢异常等;②甲状腺机能降低(胆固醇转换成胆汁酸盐减少);③胆汁淤滞症(排泄减少);④家族性高胆固醇血症(LDL受体缺乏);⑤肾病综合征(胆固醇合成亢进)。
血清胆固醇降低的有关疾病有:①甲状腺机能亢进症(转变成胆汁酸盐亢进);②重病肝病(肝产生VLDL和HDL减少);③吸收不良综合征;④营养失调;⑤无或低β脂蛋白血症(LDL减少)。如图1-4所示。
四、脂肪、磷脂、糖脂代谢
(一)脂肪代谢
脂肪的消化和吸收。膳食中的脂质主要为脂肪,此外还含少量磷脂,胆固醇等。在小肠经胆汁酸盐有作用,乳化并分散成细小的微团后,再被消化酶消化。小肠含有胰腺分泌的胰脂酶(pancreaticlipase,PL),磷脂酶A2(phospholipaseA,PLA2),胆固醇酯酶(cholesterylesterase)及辅脂酶(colipase)。胰脂酶特异催化甘油三酯的1及3位酯键水解,生成2-甘油一酯(2-monoglyceride,MG)及二分子脂肪酸。胰脂酶必须吸附在乳化脂肪微团水油界面上,才能作用于微团内的甘油三酯。辅脂酶能于胆汁酸盐及胰脂酶结合并促进胰脂酶吸附在微团的水油界面上,因而能增加胰脂酶的活性,促进脂肪的水解。磷脂酶A2催化磷脂2位酯键水解,生成脂肪酸及溶血磷脂。胆固醇酯酶促进胆固醇酯水解成游离胆固醇及脂肪酸。
脂类消化产物主要在十二指肠下段空肠上段吸收。中链脂肪酸(6-10C)及短链脂肪酸(2C-4C)构成甘油三酯,经胆汁酸盐乳化后即可被吸收,在肠粘膜细胞内脂肪酶的作用下,水解为脂肪酸及甘油,通过门静脉进入血循环。长链脂肪酸(12-26C)及2-甘油一酯吸收入肠粘膜后,在光面内质网转酰酶(acylstransferase)的催化下,由ATP供给能量,2-甘油一酯加上2分子脂酰CoA,再合成甘油三酯。后者参入乳糜微粒的组成,经淋巴进入血循环。
(二)脂肪的合成
脂肪(酰基甘油三酯)是机体储存能量的形式。肝、脂肪组织及小肠是合成甘油三酯的主要场所,以肝的合成能力最强。
甘油三酯合成原料是由葡萄糖代谢提供的甘油及脂肪酸。甘油三酯合成的两条途径,一是小肠粘膜细胞内由消化吸收的甘油一酯及脂肪酸在转酰酶的催化下合成甘油三酯。二是在肝细胞及脂肪细胞进行的合成途径-甘油二酯途径。3-磷酸甘油在转酰酶的作用下,加上2分子脂酰CoA生成磷脂酸(phosphatidicacid)。后者在磷脂酸磷酸酶的作用下,水解脱去磷酸生成1,2-甘油二酯,然后在转酰酶的催化下,再加上1分子脂酰基即生成甘油三酯。
合成脂肪的三分子酸可为同一种脂肪酸,也可是三种不同的脂肪酸。合成所需的3-磷酸甘油主要由糖代谢提供。肝、肾等组织含有甘油激酶,能利用游离甘油,使之磷酸化生成3-磷酸甘油。脂肪细胞缺乏甘油激酶因而不能利用甘油合成脂肪。
(三)磷脂的代谢
1.甘油磷脂的合成和降解
甘油磷脂可在全身各组织细胞内质网合成,内质网含有合成磷脂的酶系。但以肝、肾及肠等组织最活跃,其合成原料是脂肪酸,甘油主要由葡萄糖代谢转化而来,但多不饱和脂肪酸必须从植物油摄取,其他原料如磷酸盐、胆碱(choline)、丝氨酸、肌醇(inositol)等可来自食物和体内合成。其合成过程有两种,一是甘油二酯合成途径。磷脂酰胆碱及磷脂酰及乙醇胺主要通过此途径合成;二是CDP-甘油二酯合成途径。肌醇磷脂(phosphatidylinositol)、丝氨酸磷脂(phosphatidyline serine)及心磷脂(cardiolipin)由此途径合成,具体过程如下。

以上是磷脂合成的基本过程。此外磷脂酰胆碱亦可由磷脂酰乙醇胺从S-腺苷蛋氨酸获得甲基生成。磷脂酰丝氨酸可由磷脂酰乙醇胺羟化或其乙醇胺与丝氨酸交换生成。甘油磷脂的合成是在内质网膜外侧面进行,而在胞液中存在一类能促进磷脂在细胞内膜之间进行交换的蛋白质-磷脂交换蛋白(phospholipidexchange proteins)。不同的磷脂交换蛋白催化不同种类磷脂在膜之间进行交换。合成的磷脂通过这类蛋白的作用转移至不同的细胞器膜上,从而更新其磷脂。
甘油磷脂的降解是由多种磷脂酶类(phospholipase)分别作用于甘油磷脂分子中的不同酯键。作用于1,2位酯键的酶分别称为磷脂酶A1和A2,作用于溶血磷脂1位酯键的酶称为磷脂酶B1,作用于3位磷酸酯键的酶称为磷脂酶C,作用磷酸取代基间酯键的酶称为磷脂酶D。通过以上多种酶的作用甘油磷脂最终分解为甘油、脂肪酸、无机磷酸。
2.鞘磷脂的代谢
全身各组织均可合成鞘磷脂,但以脑组织最为活跃。内质网有合成鞘氨醇酶系,鞘胺醇是各种鞘磷脂的前体物质,其合成过程为:
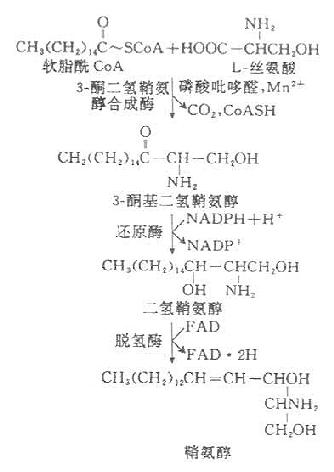
神经鞘磷脂以鞘氨醇为前体,在脂酰转移酶的催化下,其氨基与脂酰CoA进行酰胺缩合,生成N-脂酰鞘氨醇后,者由CDP-胆碱供给磷酸胆碱即生成神经鞘磷脂。
鞘磷脂的降解过程类似于磷脂的降解,在多种磷脂酶的作用下,可逐步水解。神经鞘磷脂酶存在于脑、肝、脾、肾等细胞的溶酶体中,属于磷脂酶C类,能够使磷酸酯键水解,产生磷酸胆碱及N-脂酰鞘氨醇。
(四)糖酯的代谢
1.糖基甘油酯的生物合成
糖基甘油酯分子是由糖类、甘油和脂肪酸组成的。其组成与磷脂的区别只是磷是基团被糖基所取代,因此合成过程与磷脂有许多相似之处。动物体内合成糖酯最活跃的器官是脑,亚细胞部位是微粒体。微粒体含有催化生成二半乳糖基甘油二酯的酶系。
2.糖基甘油酯的降解
脑组织含有脂肪酶和半乳糖苷酶催化半乳糖基甘油酯的水解反应。脑微粒体的半乳糖脂酶水解半乳糖基甘油二酯。动物体只有神经组织含有糖基甘油酯,其浓度在髓鞘形成期开始升高,因为它的合成速度最快,而水解酶活力又相应降低。由此表明糖脂参与了髓鞘形成的过程。糖脂降解产物是脂肪酸、半乳糖、甘油。
3.糖鞘脂代谢
哺乳动物的糖脂在肝脏和脾脏周转很快,但红细胞发育期动物的脑组织与内膜结合的糖脂半寿期却比较长。中性糖鞘脂的生物合成是通过在神经酰胺分子上顺序添加单糖而合成寡糖链,催化这一反应的酶总称为糖基转移酶,糖基供体是糖核苷酸衍生物(UDP-半乳糖,UD-P葡萄糖等,单糖从它的核苷酸衍生物转移给适宜的受体(底物)合成各种中性糖鞘脂。其中已糖苷神经酰胺的合成途径有两条。其一,是从鞘氨醇和UDP-半乳糖合成鞘氨醇半乳糖苷,由UDP-半乳糖:鞘氨醇β-半乳糖基转移酶催化,再经一个酰基转移酶合成1-0-半乳糖苷神经酰胺。但是已糖苷神经酰胺还是主要通过第二条途径合成的,即鞘氨醇首先酰化产生神经酰胺,后者再经UDP-半乳糖:N酰基鞘氨醇半乳糖转移酶催化合成1-0-半乳糖神经酰胺。
中性糖鞘脂的合成则是在多种糖基转移酶的催化下逐步合成的。如半乳糖基转移酶有催化生成α(1→4)糖苷键的酶,也有催化产生β(1→4)或β(1→3)糖苷键的酶;此外还有葡萄糖基转移酶、岩藻糖基转移酶、N-乙酰氨基葡萄糖基转移酶β(1→3)和不止一种N-乙酰氨基半乳糖转移酶催化产生β(1→3)糖苷键和催化产生а(1→3)糖苷键。
葡萄糖苷酶、N-乙酰、β-氨基乙糖苷酶、α-岩藻糖苷酶、芳香基硫酸酯酶和神经酰胺酶。由于糖鞘脂的分子结构复杂,因此每一类酶呈现多样的底物专一性。糖硝酯被以上诸酶水解生成鞘氨醇、脂肪和酸糖基。