第一节 总论
造血器官
正常人体血细胞是在骨髓及淋巴组织内生成。
造血细胞均发生于胚胎的中胚层,随胚胎发育过程,造血中心转移,出生前的造血分为三个阶段:①卵黄囊造血期始于人胚第3周,停止于第9周。卵黄囊壁上的血岛是最初的造血中心。②肝造血期肝脏造血始于人胚第6周,至第4-5个月达高峰,以红、粒细胞造血为主,不生成淋巴细胞。此阶段还有脾、肾、胸腺和淋巴结等参与造血。脾脏自第5个月有淋巴细胞形成,至出生时成为淋巴细胞的器官。6-7周的人胚已有胸腺,并开始有淋巴细胞形成,胸腺中的淋巴干细胞也来源于卵黄囊和骨髓。③骨髓造血期开始于人胚第4个月,第5个月以后始成为造血中心,从此肝脾造血渐减退,骨髓造血功能迅速增加,成为红细胞、粒细胞和巨核细胞的主要生成器官,同时也生成淋巴细胞和单核细胞。淋巴结参与红细胞生成时间很短,从人胚第4个月以后成为终生造淋巴细胞和浆细胞的器官,其多能干细胞来自胚胎肝脏和骨髓,淋巴干细胞还来自于胸腺。
刚出生时全身骨髓普遍造血,5岁以后由四肢远侧呈向心性退缩,正常成人红骨髓主要见于全身扁平骨,肱骨及股骨近端骨髓中尚残留有红骨髓组织,其余为黄骨髓。黄骨髓平时无造血功能,但在生理需要时,黄骨髓、肝、脾、甚至淋巴结可恢复造血功能,称为髓外造血(extramedullary hemopoiesis)。
造血细胞生成,调控与破坏
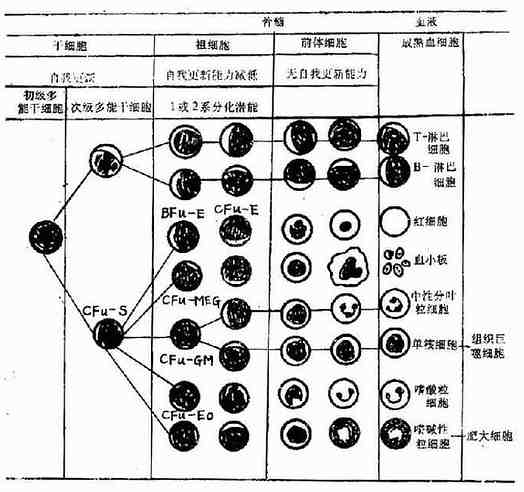
通过脾集落的研究方法证实,现已公认各种血细胞均起源于共同的骨髓造血干细胞(hemopoietic stem cell),自我更新与多向分化是造血干细胞的两大特征。血细胞的发育共分为5个阶段:①初级多能干细胞(plu ripotent stem cell),为最原始未分化干细胞;②次级多能干细胞(mu ltipotent stem cell),部分分化,如CFU-S,淋巴性干细胞;③定向组细胞(commited progenitor cell),自我复制能力有限或消失,仅具有一系或2系分化潜能;④前体细胞(prec u rsor cell),如骨髓中形态已可辩认的各系幼稚细胞;⑤各系血细胞,成熟血细胞。
血细胞生成除需要造血干细胞外,尚需有正常造血微环境及正、负造血调控因子的存在。造血组织中的非造血细胞成分,包括微血管系统、神经成分、网状细胞、基质及其他结缔组织,统称为造血微环境。造血微环境可直接与造血细胞接触或释放某些因子,影响或诱导造血细胞的生成。
调控造血功能的体液因子,包括刺激各种祖细胞增殖的正调控因子,如促红细胞生成素(erythropoietin),集落形成刺激因子(colony-stimulating factor CSF)及白细胞介素3(IL-3)等,同时亦有各系的负调控因子,二者互相制约,维持体内造血功能的恒定,血细胞的起源与分化见(图5-1-1)

图5-1-1 血细胞起源与分化模式图
红细胞的生存时间为100-120天,因此体内每天约有1/120红细胞被破坏,6.25g血红蛋白分解,同时又有相应量的红细胞及血红蛋白生成,以保持动态平衡。红细胞的生理性破坏主要是由于衰老所致。红细胞衰老时,细胞内已糖激酶、磷酸葡萄糖异构酶等逐渐失去活力,ATP酶含量亦渐降低,因而导致依赖于能量代谢的过程产生障碍,此外磷酸已糖旁路的衰竭也导致血红蛋白结构和功能的改变。衰老的红细胞渗透脆性增加,可变形性减小,变成球形。衰老的红细胞10%在血管内破坏,但绝大部分在血管外破坏,其中脾脏起重要作用,衰老而变形性小的红细胞在脾循环中被阻留并被单核巨噬细胞所吞噬。肝脏也是破坏衰老红细胞的重要场所之一。其它器官的单核-巨噬细胞也有清除异常红细胞的能力,但效率较小。
由于骨髓造血的代偿能力为正常造血的6-8倍,当红细胞的生存时间短至10天(正常的1/12),每天约有75g血红蛋白破坏,此时红细胞破坏超过了骨髓的代偿程度,而出现贫血。由于脾脏是识别、破坏异常红细胞主要器官,因此临床上采用脾切除治疗某些溶血性贫血。
粒细胞在骨髓中成熟后即进入血液中,在循环中停留时间短,半存留期为6-7小时,然后进入组织内再重往血管内,成熟中性粒细胞存活期为9天。主要被单核-巨噬细胞破坏,亦可随各器官的分泌物排出体外。
单核细胞在骨髓中成熟后立即进入循环,其半衰期为71小时,以后进入组织成为组织巨噬细胞。
淋巴细胞可分为短寿及长寿两群,前者存活4-5天,后者经数月或数年未分裂而存活。二者功能上的意义还不清楚。淋巴细胞可在静脉-淋巴间进行循环,在其寿期内可往返循环达数百次之多。
血小板的寿命为7-10天,衰老的血小板为单核巨噬系统所清除。血小板与粒细胞不同,在骨髓中并无储备,如血小板被大量破坏,则恢复较慢,至少3-5天始能恢复正常,这正是巨核细胞成熟至产生血小板所需要的时间。
因此,当骨髓功能发生严重障碍时,首先出现的症状为粒细胞缺乏所致的感染,随之为血小板减少所致的出血倾向,最后出现贫血,而淋巴细胞减少所致的免疫功能低下则十分隐袭而且迟缓。
血液病分类
一、造血干细胞病
(一)再生障碍性贫血
(二)骨髓增生性疾病(myeloproliferative diseases)如骨髓纤维化,慢性粒细胞白血病、真性红细胞增多症,原发性血小板增多症。
(三)骨髓增生异常综合征(myelodysplastic syndrome)如难治性贫血、环形铁粒细胞性难治性贫血、慢性粒单细胞白血病等。
(四)阵发性睡眠性血戏蛋白尿。
二、红细胞病
(一)贫血 如红细胞生成和成熟障碍、DNA合成障碍、血红蛋白合成障碍、红细胞破坏过多、红细胞丢失过多等。
(二)红细胞增多症 真性红细胞增多症、继发性红细胞增多症。
三、白细胞疾病
(一)白细胞减少 各种原因所致的白细胞减少及粒细胞缺乏。
(二)白细胞增多 中性粒细胞增多症、嗜酸性粒细胞增多症,传染性单核细胞和传染性淋巴细胞增多症。
(三)白细胞质的异常 粒细胞功能异常、白血病、淋巴瘤、骨髓瘤及恶性组织细胞病。
四、出血性疾病
(一)血管壁异常 过敏性紫癜、毛细血管扩张症。
(二)血小板疾病
1.血小板减少 原发及继发血小板减少症。
2.血小板增多 原发及继发血小板增多症。
3.血小板质的异常 遗传性血小板功能缺陷,如血小板无力症、巨大血小板综合征等。继发性血小板功能缺陷,如尿毒症。
(三)凝血功能障碍
1.凝血功能低下 各种原因所致的凝血因子减少(血友病、维生素k缺乏)、血浆中抗凝物质增加。
2.凝血功能亢进 DIC早期,血栓性疾病。
血液病的诊断
一、病史采集
血液病的常见症状有贫血、出血倾向,发热或易感染,肿块、肝、脾、淋巴结肿大,骨痛等。对每一患者应了解这些症状的有无及特点。还应询问有无药物及毒物接触史,营养及饮食习惯,手术史,月经孕产史及家族史。
二、体格检查
皮肤粘膜颜色、出血点,皮肤结节或斑块,黄疸,舌乳头、浅表淋巴结,胸骨压痛,肝脾有无肿大,腹部有无肿块等。
三、实验室检查
(一)血常规及血小板计数,为最基本的化验检查。
(二)网积红细胞计数,以了解骨髓增生情况。各种红细胞平均指数的测定,对贫血患者进行形态学分类,有助于寻找贫血的原因。
(三)骨髓检查 包括骨髓穿刺涂片及骨髓活体组织检查,对某些血液病有确诊价值(如白血病、骨髓瘤、骨髓纤维化等)及参考价值(如增生性贫血)。
(四)出血性疾病 出血时间、凝血时间、凝血酶原时间、白陶土部分凝血活酶时间、纤维蛋白原定量为基本的检查。尚可做血块回缩试验、血小板聚集和粘附试验以了解血小板功能。
(五)溶血性疾病检查 常用的试验有游离血红蛋白测定、血浆结合珠蛋白测定、Rous/试验、尿潜血(血管内溶血);酸溶血试验、蔗糖水试验(PNH);渗透脆性试验(先天性球成形红细胞增多症);高铁血红蛋白还原试验(G6PD酶缺乏);抗人球蛋白试验(自身免疫性溶贫)等以确定溶血原因。
(六)细胞化学染色 对诊断急性白血病的类型有价值,如过氧化酶、碱性磷酸酶、非特异性酯酶等。
(七)活体组织检查 如淋巴结或浸润包块的活检对诊断淋巴瘤或恶性血液病的浸润有诊断价值。
(八)生化及免疫学检查 自身免疫性血液病及淋巴系统常有免疫球蛋白的异常及细胞免疫功能的异常。近年来已应用单克隆抗体对急性白血病进行免疫学分型。
(九)器械检查 如超声波、CT对纵膈及腹膜后淋巴瘤的诊断。
(十)放射性核素 应用于红细胞寿命、红细胞破坏部位测定,骨髓显像、淋巴瘤显像等。
血液学进展
近10年来,由于免疫学、生物化学、细胞遗传学及分子生物学等基础学科的进步,以及与血液病学的相互渗透,血液学也随之发生了突飞猛进的进展。
一、造血与调控
造血干细胞是生成血细胞的原始细胞。研究造血干细胞增殖、分化与调控的目的在于阐明血细胞的生成机理,并为血液病的发病机理。诊断及治疗提供科学依据。采用天然的性染色体作为细胞遗传标志,结合造血干细胞研究中的脾结节生成细胞是一类多能造血干细胞。骨髓、胎肝及外周血均可形成脾结节,证明其中均含有造血干细胞。且在临床上已应用骨髓、胎肝及外周血中的造血干细胞移植治疗急性白血病取得成功。目前正致力于提取纯化造血干细胞和开展体外造血干细胞培养扩增技术。
血细胞是在造血组织这一特定环境中由少数造血干细胞通过不断的增殖、分化而生成。在造血组织中造血微环境,尤其是间质细胞对造血干细胞的发育起重要作用,通过细胞与细胞间直接接触,以及间质细胞及其他细胞释放因子,调控血细胞的增殖活动。其中一些多肽因子受到重视,有正负增殖调控因子。目前已有基因工程产品,且陆续应用于临床。
造血增殖正调控因子应用骨髓细胞体外培养技术,证实培养液中存在负责刺激血细胞生长因子,称集落刺激因子(Colony-stimulating factor CSF)。
CSF-1:又称M-CSF,在骨髓细胞体外琼脂培养中可以诱导生成巨噬细胞组成的集落。
G-CSF:可以刺激骨髓细胞生成由粒系细胞组成的集落,已用于治疗①各种粒细胞减少症;②与抗生素联合治疗严重感染;③治疗MDS。
GM-CSF:刺激骨髓细胞生成由粒与巨噬细胞组成的集落。已用于治疗①同G-CSF;②造血功能障碍,如再障、MDS;③抗肿瘤,通过单核巨噬细胞作用。
除以上三种CSF外,还有一些造血因子是在研究T、B细胞分化中发现的,即白细胞介素(Interlukine IL),目前已知IL1-IL10,其中IL-3可以刺激骨髓细胞形成混合集落,具有多向性造血刺激作用,可治疗造血功能障碍性疾病。
Epo(促红细胞生成素)是较早的基因重组产品,目前临床已用于治疗肾性贫血、慢性炎症性贫血和肿瘤性贫血,取得良好效果。
1990年美国发现造血干细胞因子(SCF)、且已有重组产品。SCF、GM-CSF、G-CSF、IL-3、Epo等在刺激血细胞生成中有协同作用。
在造血增殖负调控因子中有T细胞源、巨噬细胞源、LAK细胞源CIA(Colony inhibiting activity),其中以对干扰素(IFN)及肿瘤坏死因子(TNF)研究较多。
二、IL-2/LAK细胞在肿瘤继承免疫治疗中的应用
继承免疫是指给肿瘤患者整体输入具有抗瘤活性的因子和/或细胞,直接或间接地导致肿瘤消退。
IL-2是由TH细胞分泌的一种淋巴因子,属糖蛋白,具有广泛的免疫活性:①刺激T细胞增殖分化;②刺激产生CTL;③促进多种细胞因子分泌;④刺激NK细胞增殖分化,增强NK活性;⑤促进B细胞增殖分化;⑥刺激产生LAK细胞,即淋巴细胞在IL-2刺激下,经3-6天体外培养可成为一种对新鲜肿瘤细胞具有强烈杀伤作用的细胞,称为淋巴因子激活的杀伤细胞(LAK细胞)。LAK细胞可杀伤自体同种异体新鲜肿瘤细胞,对正常细胞无杀伤作用。联合应用IL-2和LAK细胞可取得更好的抗肿瘤效果,IL-2可使输入的LAK细胞在体内继续增殖。LAK细胞数量与IL-2剂量与疗效直接相关,临床上已用于各种实体瘤的治疗取得良好效果;亦有少数报道治疗急性白血病,亦可和化疗联合并用。治疗中存在的问题是rh IL-2比较昂贵、毒性大、获得大量LAK细胞亦较困难。
1986年人们发现实体肿瘤组织中分离到的肿瘤浸润淋巴细胞(tumor intiltration lymphocyte ,TIL)在体外经IL-2激活后可大量扩增并具有较LAK细胞强的杀瘤活性,且并用较小剂量的IL-2即可有明显的作用。
三、单克隆抗体在血液学领域中的应用
(一)研究红细胞及其相关抗原 ①可代替目前以抗血清作为血型鉴定的方法,如已获得高亲和力和特异性的抗A和抗B单抗;②研究血型抗原的多态性,发现新抗原,如发现Rh阳性D抗原就有7种变异;③从细胞膜上分离抗原,进行生化分型;④研究血型抗原的肽谱。
(二)HLA抗系统的研究 HLA抗原在移植免疫和某些疾病发病中有十分重要的作用。抗HLA单抗用于;①取代目前HLA定型的试剂;②发现新抗原;③分离HLA抗原进行生化分析;④研究HLA抗原功能及其与疾病发生及预后关系。
(三)在血液病诊断中的应用
1.急性白血病 在实践中已发现FAB分类的不足及认识不统一。1986年提出形态学、免疫学及细胞遗传学,即MIC的分类诊断。在免疫学诊断中,目前应用CD系列McAb对急性白血病进行免疫分型。ALL的免疫分型进展迅速,1983年以前ALL一般分为T-ALL、B-ALL、Pre-B-ALL、NuII-ALL和普通型急淋(C-ALL),其中C-ALL和Pre-B-ALL预后最好,N-ALL、T-ALL次之,B-ALL最差。随着McAb进展,又将ALL分为T-ALL及非T-ALL两大类,后者又分为6个亚型:Ⅰ型表达DR+;Ⅱ型:DR+,B4+;Ⅲ型:DR+、B4+、CALLA+;Ⅳ型;DR+、B4+、CALLA+、B1+;Ⅴ型:Cu重链阳性;Ⅵ型:SmIg阳性,McAb在AML上进展缓慢,尚未见到对每一FAB亚型特异的免疫表型,但也有某些相关性,如用抗血小板McAbⅡb/Ⅲa和纯红细胞抗体(Glycophorina),可分别对M7和M6有肯定性诊断价值。
2.出血性疾病 通过抗血小板单抗发现了血小板膜糖蛋白(GP)的性质与血小板反应的关系,阐明了一些血小板诱聚剂的受体。发现了巨大血小板症和血小板无力症分别与血小板表面GpIb和GpⅡb/Ⅲa的缺陷有关。利用GpⅡb/ⅢaMcAb进一步证实了GpⅡb/Ⅲa是纤维蛋白原的受体,在活化血小板中是VWF和纤维连接蛋白的受体,后二者在血小板粘附于血管内皮下起重要作用。纤维蛋白原、VWF和纤维连接蛋白属粘附蛋白,与GpⅡb/Ⅲa是粘附蛋白受体超家系成员之一。
3.了解造血细胞的个体发育过程与细胞恶变之间的关系,对淋巴细胞亚群的分化过程和激活状态的研究已取得很大的成绩。
(四)在血液病治疗中的应用
1.探索造血干细胞表面标记,分离和浓缩造血干细胞,代替骨髓移植。
2.应用于骨髓移植 用抗T-细胞McAb清除异基因供髓者骨髓中免疫活性细胞,减轻GVHD。在ABMT中清除自身骨髓中的残留白血病细胞以减少复发。
3.治疗急性白血病或淋巴留 单独应用特异的McAb 或将McAb与同位素,毒素或细胞毒药物偶合成“生物导弹”。
4.血栓导向诊断与治疗 常用的McAb有抗纤维蛋白和抗活化血小板单杭,将其与同位素(111In、99mTC、128I和131I等)标记后使成为血栓导向显像剂,阳性率可高达95%。将上述McAb与溶栓药物偶联成为单杭导向溶栓剂,特异性及疗效均较好。
5.再障 根据原发再障发病机理,应用抗IL-2受体McAb进行治疗。
单抗在治疗中应用还处于早期阶段,取得确切疗效,尚需克服许多困难。
四、急性白血症治疗进展
当前白血病的治疗仍以化疗为主,其策略是在实施个体化治疗前提下,给予联合、大剂量强烈诱导和早期强化治疗。近几年突出的进展是新药问世,主要有蒽环类,包括阿克拉霉素(Aclarubicin),4-去甲氧柔红霉素(Idarubicin),表阿霉素(Epirubicin),长春花碱酰胺(vendestine),胺苯吖啶(Amsacrine AMSA),去氧肋间型霉素(Pentostatin),VP16(Etopside)及VM26(Teniposide),米托蒽醌(Mitoxantrone)等。
骨髓移植 骨髓移植(BMT)的研究发展迅速,据国际骨髓移植登记组至1988年底资料,已进行异基因BMT二万余例,治疗病种20余种,70%以上是白血症,第一次完全缓解(CR1)的AML患者,移植后五年生存率为50±5%,复发率为20±5%,相当年龄组化疗患者3年生存率为25-40%,提示BMT优于化疗。儿童CR1ALL化疗优于BMT,但高危及杂合白血病除外,成人CR1ALL化疗与BMT疗效相当,对CR2ALL则BMT优于化疗。
ABMT治疗急性白血病已1300余例,目前研究的热点是探索有效的预处理方案,有效的体外净化骨髓方法以及微小残留病的检测。
诱导分化治疗 近年来取得很大进展。
(一)诱导分化使肿瘤消失 使肿瘤干细胞分化超过增殖,经一定时间后肿瘤干细胞库渐趋衰竭。肿瘤细胞分化为一种新表型,对体液因子的调控恢复正常,即使肿瘤不能完全消失,其体积亦可明显缩小。
(二)防止肿瘤重新生长及预防转移。
(三)使增生异常的细胞向正常途径分化,如治疗MDS,粘膜白斑病等。
(四)作为化疗或放疗的一种辅助治疗。
国内应用全反式维甲酸治疗急性早幼粒细胞型白血病,CR率达88.2%。此外临床应用的诱导分化剂有1.25二羟D3、小剂量Ara-c、三尖杉酯硷、干扰素、集落刺激因子等。
五、癌基因与白血病
近年来通过分子遗传学研究证实,人类肿瘤与癌基因密切相关。癌基因是一类具有转化正常细胞潜能的DNa 序列。癌基因有两类:存在于逆转录病毒中能使细胞恶性转化的核苷酸序列称为病毒癌基因(V-Onc),后者仅在细胞周期的一定时间呈低水平表达,参与细胞增殖、分化的调控。白血病的发生是由于某些癌基因被活化的结果,几乎所有的白血病患者均有C-myc或Ha-ras基因表达,急粒亦可表达N-ras,在疾病活动期表达增高。基因活化一般通过三种途径:①点突变:原癌基因在编码顺序的特定位置上,一个核苷酸发生突变,使相应一个氨基酸发生变化;②扩增:某些癌基因在原来染色体上复制多个烤贝,结果基因产物增加,导致细胞功能异常;③易位:癌基因从原正常位置转移到其他染色体上,使其静止的癌基因变为活化的癌基因。
癌基因临床应用前景 ①阐明白血病发病机理;②早期诊断在MDS时随着病 情向白血病方向转化,c-myc表达水平进行性增高;③判断预后c-myc表达水平与化疗缓解间有关,高表达者化疗不敏感或易复发;④基因治疗将Onc特异的反义链RNA导入白血病细胞内,选择性阻断其相应的mRNA蛋白翻译过程,从而逆转白血病细胞,或者将某些位于白血病细胞膜表面的Onc蛋白产物作为靶抗原与偶联有抗癌药物的McAb特异结合,进行导向治疗。
(沈素芸)