第十五章 泌尿系统
泌尿系统包括肾、输尿管、膀胱和尿道等器官。肾是泌尿器官,其余为贮尿和排尿器官。
一、肾
肾是人体最主要的排泄器官,它以尿形成的方式排除体内的代谢废物,同时对人体的水盐代谢和离子平衡起调节作用,以维持机体内环境理化性质的相对稳定,此外,肾还有分泌多种生物活性物质的功能。
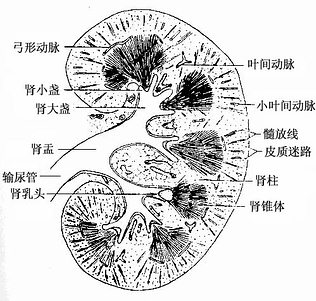
肾形似蚕豆,内缘中部凹陷为肾门,输尿管、血管、神经和淋巴管经此出入。肾表面包以致密结缔组织构成的被膜,称肾纤维膜,正 常新鲜肾的被膜易剥离,在肾病时此膜易与肾实质粘连而不易剥离。肾实质分为皮质和髓质。新鲜肾的冠状剖面上,皮质呈红竭色,颗粒状,髓质由10余个肾锥体(renal pyramid)组成,肾锥体呈浅红色条纹状(图15-1)。锥体尖端钝圆,突入肾小盏内,称肾乳头,乳头管开口于此处,尿液由此排至肾小盏内。肾锥体的底与皮质相连接,从肾锥体底呈辐谢状伸入皮质的条纹称髓放线(medullary ray),位于髓放线之间的肾皮质称皮质迷路(cortical labyrinty)。每个髓放线及其周围的皮质迷路组成一个肾小叶,皮质迷路中央部分为小叶间,其中有小叶间动脉和静脉穿行。一个肾锥体与相连的皮质组成肾叶,但成人的肾叶分界不清,胎儿和婴儿肾表面可见肾叶轮廓。位于肾锥体之间的皮质部分,称为肾柱(图15-1)。

图15-1 肾冠状剖面模式图
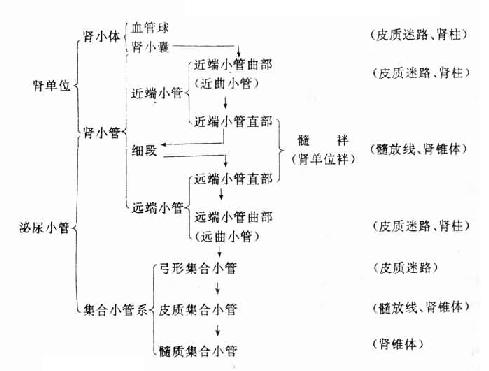
肾实质由大量泌尿小管组成,其间有少量结缔组织、血管和神经等构成肾间质。泌尿小管(uriniferous tubule)是由单层上皮构成的管道,包括肾小管和集合小管系两部分。肾小管是长而不分支的弯曲管道。每条肾小管起始端膨大内陷成双层的囊(肾小囊),并与血管球共同构成肾小体,肾小管的末端与集合小管相接。每个肾小体和一条与它相连的肾小管是尿液形成的结构和功能单位,称肾单位。泌尿小管各段在肾实质内的分布是有规律的,肾小体和蟠曲走行的肾小管位于皮质迷路和肾柱内,肾小管的直行部分与集合小管系共同位于肾锥体和髓放线内(表15-1)。
表15-1 泌尿小管组成和各段的位置
(一)肾单位
肾单位( nephron)是肾成尿液的结构和功能单位,由肾小体和肾小管两部分组成,每个肾约100万个以上的肾单位,它与集合小管系共同行使泌尿功能。
肾小体位于皮质迷路和肾柱内,一端与肾小管相连。肾小管的起始段在肾小体附近蟠曲走行,称近端小管曲部或近曲小管,继而离开皮质迷路入髓放线,从髓放线直行向下进入肾锥体,称近端小管直部。随后管径骤然变细,称为细段。细段之后管径又骤然增粗,并返折向上走行于肾锥体和髓放线内,称为远端小管直部。近端小管直部、细段和远端小管直部三者构成“U”形的袢,称为髓袢(medullary loop),又称Henle袢或肾单位袢(nephron loop)。髓袢由皮质向髓质方向下行的一段称降支,而由髓质向皮质方向上行的一段称升支。髓袢长短不一,长者可达乳头部,短者只存在于髓放线中。远端小管直部离开髓放线后,在皮质迷路内蟠曲走行于原肾小体附近,称为远端小管曲部(或称远曲小管),最后汇入集合小管系(图15-2)。
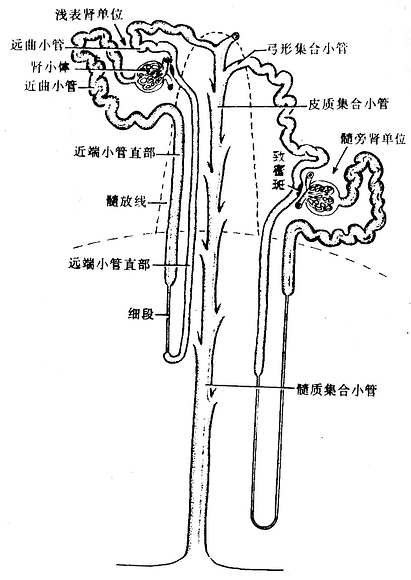
图15-2 肾单位和集合小管系模式图
根据肾小体在皮质中深浅位置不同,可将肾单位分为浅表肾单位和髓旁肾单位两种(图15-2)。浅表肾单位(superfacial nephron)又称皮质肾单位(cortical nephron),其肾小体位于皮质浅部,肾小体体积较小,髓袢和细段均较短。浅表肾单位数量多,约占肾单位总数的85%,肾小体体积较大,髓袢和细段均较长。髓旁肾单位数量较少,约占肾单位总数的15%,对尿液浓缩具有重要的生理意义。
1.肾小体 肾小体(renal corpuscle)似球形,故又称肾小球,直径约200μm,由肾小囊和血管球组成(图15-3,15-4)。肾小体有两端或谓两极,微动脉出入的一端称血管极,另一端在血管极的对侧,肾小囊与近端小管相连接称尿极。
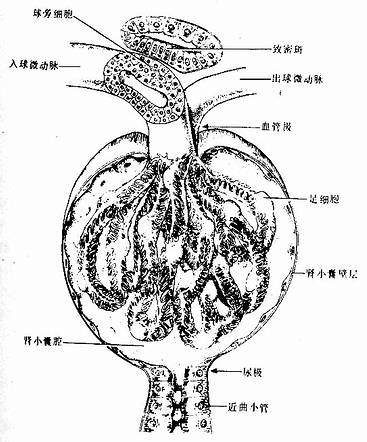
图15-3 肾小体与球旁复合体立体模式图
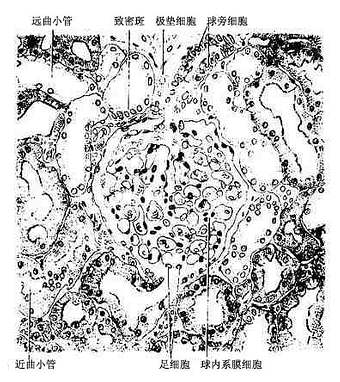
图15-4 肾皮质(高倍)
(1)血管球(glomerulus):是包在肾小囊中的一团蟠曲的毛细血管(图15-3,15-4)。一条入球微动脉从血管极处突入肾小囊内,分成4~5支,每支再分支形成网状毛细血管袢,每个血管袢之间在有血管系膜支持,毛细血管继而又汇成一条出球微动脉,从血管极处离开肾小囊。因此,血管球是一种动脉性毛细血管网。由于入球微动脉管径较出球微动脉粗,故血管球内的血压较一般毛细血管的高,当血液流经血管球时大量水和小分子物质易于滤出管壁而入肾小囊内。电镜下,血管球毛细血管为有孔型(图15-5,15-6),孔径50~100nm ,有利于滤过功能。在内皮细胞的腔面覆有一层带负电荷的富含唾液酸的糖蛋白(细胞衣),对血液中的物质有选择性通透作用。内皮外面大都有基膜,但在面向血管系膜一侧的内皮则无基膜,此处的内皮细胞与系膜直接接触(图15-5)。
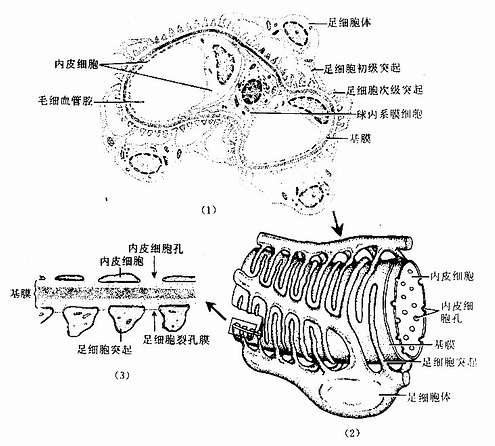
图15-5 肾血管球毛细血管、基膜和足细胞超微结构模式图
(1)切面图 (2)立体示意图 (3)滤过屏障示意图
血管系膜(mesangium)又称球内系膜(intraglomerular mesangium),位于血管球毛细血管之间,邻接毛细血管内皮或基膜,主要由系膜细胞和系膜基质组成(图15-5)。系膜细胞(mesangial cell)形态不规则,细胞突起可伸至内皮与基膜之间,或经内皮细胞之间伸入毛细血管腔内,细胞核较小,染色较深,胞质内有较发达的粗面内质网、高尔基复合体、溶酶体和吞噬泡等,有时还可见有少量分泌颗粒;胞体和突起内有微管、微丝和中间丝。目前认为系膜细胞来源于平滑肌细胞。系膜细胞能合成基膜和系膜基质的成分,还可吞噬和降解沉积在基膜上的免疫复合物,以维持基膜的通透性。并参与基膜的更新和修复。细胞的收缩活动可调节毛细血管的管径以影响血管球内血流量。系膜细胞还可分泌肾素和酶等生物活性物质,可能与血管球内血流量的局部调节有关。正常情况下的系膜细胞更新缓慢,但在病理情况下(如肾炎时),细胞增生活跃,吞噬和清除作用也增强。系膜基质填充在系细胞之间,在血管球内起支持和通透作用。血管系膜内还可少量巨噬细胞。
(2)肾小囊(renal capsule)又称Bowman囊,是肾小管起始部膨大凹陷而成的双层囊,似杯状,囊内有血管球(图15-3,15-4)。肾小囊外层(或称肾小囊壁层)为单层扁平上皮,在肾小体的尿极处与近端小管上皮相连续,在血管极处反折为肾小囊内层(或称肾小囊脏层),两层上皮之间的狭窄腔隙称肾小囊腔,与近曲小管腔相通。内层细有胞形态特殊,有许多大小不等的突起,称为足细胞(podocyte)(图15-5,15-6)。足细胞体积较大,胞体凸向肾小囊腔,核染色较浅,胞质内有丰富的细胞器,在扫描电镜下,可见从胞体伸出几个大的初级突起,继而再分成许多指状的次级突起,相邻的次级突起相互穿插成指状相嵌,形成栅栏状,紧贴在毛细血管基膜外面(图15-7)。突起之间有直径约25nm的裂隙,称裂孔(slit pore),孔上覆盖一层厚4-6nm的裂孔膜(slit membrane)(图15-5)。突起内含较多微丝,微丝收缩可使突起活动而改变裂孔的宽度。足细胞表面也覆有一层富含唾液酸的糖蛋白。

图15-6 肾小体电镜像 ×14500
PB足细胞体,PI肾小囊壁层,Lu肾小囊腔,Cap毛细血管
(白求恩医科大学尹昕、朱秀雄教授供图)
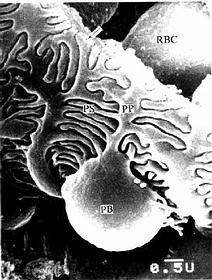
图15-7 兔肾小体扫描电镜像示足细胞
PB足细胞体,PP初级突起,PS次级突起,RBC红细胞,
↑基膜(河北医学院电镜供图)
(3)血管球基膜(glomerular basement membrane):血管球基膜较厚(成人的基膜厚约330nm),位于足细胞次级突起与毛细血管内皮细胞之间或足细胞次级突起与血管系膜之间,光镜下基膜为均质状,PAS反应阳性。电镜下可见基膜分三层,中层较厚而致密,内、外层较薄而稀疏(图15-5,15-6)。基膜内主要含有Ⅳ型胶原蛋白、蛋白多糖和层粘连蛋白(laminin),形成以Ⅳ型胶原蛋白为骨架的分子筛(图15-8),骨架上附有的糖胺多糖是以带负电荷的硫酸肝素为主,故基膜对滤液中的大分子物质有选择性通透作用。
肾小体类似一个滤过器,以滤过方式形成滤液。当血液流经血管球毛细血管时,管内血压较高,血浆内部分物质经有孔内皮、基膜和足细胞裂孔膜滤入肾小囊腔。这三层结构称为滤过膜(filtration membrane),或称滤过屏障(filtration barrier)(图15-5,15-6,15-8)。滤入肾小囊腔的滤液称原尿,原尿除不含大分子的蛋白质外,其成分与血浆相似。滤过膜的三层结构分别对血浆成分具有选择性通透作用。
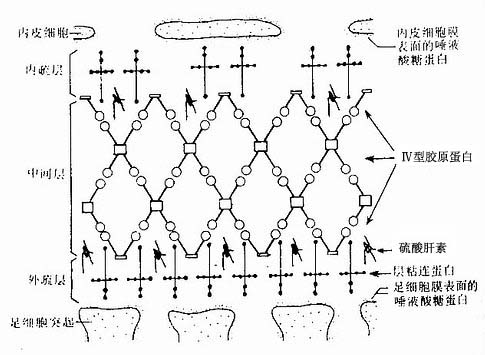
图15-8 血管球基膜结构示意图
一般情况下,分子量7万以下的物质可通过滤过膜,如葡萄糖、多肽、尿素、电解质和水等;而大分子物质则不能通过或被选择性通透,这取决于被通透物质的大小、电荷性质和分子形状等因素。如分子量为69kD的白蛋白可少量滤过,而分子量在150~200kD的免疫球蛋白阻滞在基膜内而不能通过。毛细血管内皮表面和足细胞表面均含有带负电荷的唾液酸糖蛋白,基膜内还有带负电荷的硫酸肝素(图15-8)。这些负电荷的成分可排斥血浆内带负电荷的物质通过滤过膜,这对防止血浆蛋白质滤出具有重要的生理意义。一些肾病患者的肾滤过膜内这些带负电荷糖蛋白的丧失,可能是导致蛋白尿的原因之一。另外,被通透物质的分子形状也可影响它的通透性,如椭圆形的蛋白分子比球形的蛋白分子易通过滤过膜,此乃因前者有可能以其较小的半径处通过滤过膜孔隙。
在成人,一昼夜两肾可形成原尿约180L(每分钟125ml )。若滤过膜受损害,则血浆大分子蛋白质甚至血细胞均可通过滤过膜漏出,出现蛋白尿或血尿。当系膜细胞清除了基膜内沉积物,内皮细胞和足细胞再建新的基膜后,滤过膜功能又可恢复。
2.肾小管 肾小管(renal tubule)是由单层上皮细胞围成的小管,上皮外方为基膜及少量结缔组织。肾小管分为近端小管、细段和远端小管三部分,近端小管与肾小囊相连,远端小管连接集合小管。肾小管有重吸收原尿中的某些成分和排泌等作用。
(1)近端小管(proximal tubule):是肾小管中最长最粗的一段,管径50~60μm ,长约14mm,,约占肾小管总长的一半。近端小管分曲部和直部两段。
近端小管曲部:简称近曲小管(proximal convoluted tubule),位于皮质内,起于肾小体尿极,迂曲蟠行于肾小体附近(图15-2,15-9)。生理情况下,原尿不断进入近曲小管内,故管腔呈扩张状态,若因血流受阻等病变而致原尿生成减少时,管腔缩小甚至闭合。曲部管壁上皮细胞为立方形或锥体形,胞体较大,细胞分界不清,胞质嗜酸性,胞核呈球形,位于近基部。上皮细胞腔面有紧密排列的刷状缘,细胞基部有纵纹(图15-4,15-9)。电镜下可见刷状缘由大量密集而排列整齐的微绒毛组成(图15-9,15-10),每μm 2约有150根,使细胞游离面的表面积大为扩大(两肾近曲小管表面积总计可达50~60m2)。刷状缘处有丰富的碱性磷酸酶和ATP酶等,此酶与细胞的重吸收功能有关。微绒毛基部之间细胞膜内陷形成顶小管和顶小泡(图15-9,15-10),若从血管内注入示踪物――辣根过氧化酶,可迅速滤入原尿,继而出现在近端小管上皮细胞的顶小管和顶小泡内,这提示小管上皮细胞可以胞饮方式重吸收原尿内的蛋白质等较大分子物质。上皮细胞的侧面有许多侧突(图15-10),相邻细胞的侧突相互嵌合,或伸入相邻细胞质膜内褶的空隙内,两者构成广泛的弯曲复杂的细胞间迷路,故光镜下细胞分界不清。细胞基部胞膜内陷成发达的质膜内褶,内褶之间有许多纵向排列的杆状线粒体(图15-9,15-10),形成光镜下的纵纹,侧突和质膜内褶使细胞侧面及基面与间质之间的物质交换面积增大。在细胞基部的质膜上有丰富的Na+、K+、ATP酶(钠泵),可将细胞内钠离子泵入细胞间质。
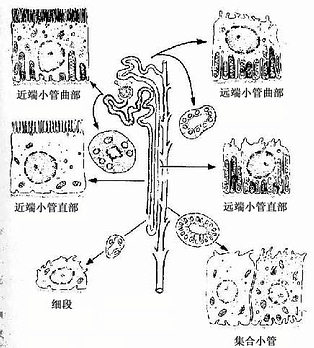
图15-9 泌尿小管各段上皮细胞结构模式图
近端小管直部:是曲部的延续,直行于髓放线和锥体内,其结构与曲部基本相似,但上皮细胞较矮,微绒毛、侧突和质膜内褶等不如曲部发达(图15-9)。

15-10近曲小管上皮细胞超微结构立体模式图
近端小管的上述结构特点使其具有良好的吸收功能,它是原尿重吸收的主要场所,原尿中几乎全部葡萄糖、氨基酸和蛋白质以及大部分水、离子和尿素等均在此重吸收。此外,近端小管还向腔内分泌氢离子、氨、肌酐和马尿酸等,还能转运和排出血液中的酚红和青霉素等药物。临床利用马尿酸或酚红排泄试验,来检测近端小管的功能状态。
(2)细段(thin segment ):位于髓放线和肾锥体内。浅表肾单位的细段较短,主要位于髓袢降支,髓旁肾单位细段长,由降支再返折上行,又参与构成升支。细段管径细,直径10~15μm,管壁为单层扁平上皮(图15-9,15-11),细胞含核部分突向管腔,胞质着色较浅,无刷状缘。电镜下,上皮细胞游离面有少量短微绒毛,基底面有少量内褶。细段上皮甚薄,有利水和离子通透。
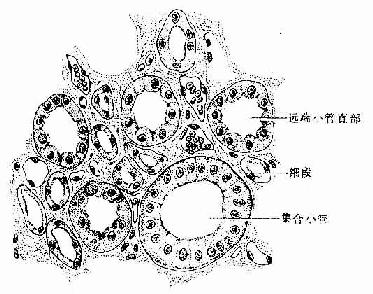
图15-11 肾髓质(高倍)
(3)远端小管(distal tubule):包括远端小管直部和曲部。管腔较大而规则,管壁上皮细胞呈立方形,细胞体积较近端小管的小,着色浅,细胞分界较清楚,核位于中央,游离面无刷状缘,基部纵纹较明显(图15-4,15-11)。
远端小管直部:经锥体和髓放线上行至皮质,是髓袢升支的重要组成部分。管径约30μm,长约9mm.电镜下,细胞表面有少量短而小的微绒毛,基部质膜内褶发达,长的内褶可伸达细胞顶部,质膜的内褶间的线粒体细长(图15-9,15-12),基部质膜上有丰富的Na+、K+-ATP酶,能主动向间质转运Na+,细胞膜还可能有一种呈凝状不通透水的酸性糖蛋白,致使水不能通过,因此造成从肾锥体底至肾乳头的间质内的渗透压逐步增高,有利于集合小系对水的重吸收。
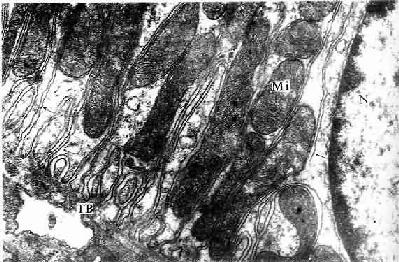
图15-12 小鼠肾远端小管上皮细胞基部电镜像×20000
TB小管基膜,Mi线粒体,N细胞核,↑质膜内褶
(白求恩医科大学尹昕、朱秀雄教授供图)
远端小管曲部:简称远曲小管(distal convoluted tubule)位于皮质内,直径35~45μm,长4.6~5.2mm,其超微结构与直部相似,但质膜内褶和线粒体不如直部发达(图15-9)。远曲小管是离子交换的重要部位,细胞有吸收水、Na+和排出K+、H+、NH3等作用,对维持体液的酸碱平衡起重要作用。肾上腺皮质分泌的醛固酮能促进此段重吸收Na+,排出K+,垂体后叶抗利尿激素能促进此段对水的重吸收,使尿液浓缩,尿量减少。
(二)集合小管系
集合小管系(collecting tubule system )全长20~38mm ,可分为弓形集合小管、皮质集合小管三段(图15-2)。弓形集合小管很短,位于皮质迷路内,一端连接远曲小管,呈弧形弯入髓放线,与皮质集合小管相连。皮质集合小管沿髓放线直行向下达肾锥体,髓质集合小管在肾锥体内下行至肾锥体乳头,改称乳头管,开口于肾小盏。集合小管下行时沿途有许多远端小管曲部汇入。集合小管系的管径由细(直径40μm)逐渐变粗(直径200~300μm),随管径的增粗,管壁上皮由单层立方逐渐增高为单层柱状(图15-11),至乳头管处成为高柱状上皮。集合小管上皮细胞胞质色淡而明亮,细胞分界清楚,核圆形,位于中央,着色较深。细胞超微结构比远端小管简单,细胞器少,细胞离面亦有少量短微绒毛,也可见少量侧突和短小的质膜内褶(图15-9)。但也有部分细胞的细胞器较多,胞质内有碳酸酐酶,它与细胞分泌H+或HCO3-的功能有关。集合小管能进一步重吸收水和交换离子,使原尿进一步浓缩,并与远端小管曲部一样也受醛固酮和抗利尿激素的调节。
综上所述,肾小体形成的滤液,经过肾小管和段和集合小管后,原尿中绝大部分水、营养物质和无机盐等又被重吸收入血,部分离子也在此进行交换;小管上皮细胞还分泌排出机体部分代谢产物。滤液经远曲小管和集合小管时又进一步浓缩,最终形成终尿经乳头管排入肾小盏,其量为每天1~2升,仅占肾小体滤液的1%左右。因此,肾在泌尿过程中不仅排出了机体的代谢产物,而且对维持机体水盐平衡和内环境的稳定起重要作用。
(三)球旁复合体
球旁复合体(juxtaglomerular complex)也称肾小球旁器(juxtaglomerular apparatus)由球旁细胞、致密斑和球外系膜细胞组成。它位于肾小体的血管极处,大致呈三角形,致密斑为三角形的底,入球微脉和出球微动脉分别形成三角形的两个侧边,球外系膜细胞则位三角区的中心(图15-3,15-13)。
1.球旁细胞入球微动脉行至近肾小体血管极处,其血管壁中膜的平滑肌细胞转变为上皮样细胞,称为球旁细胞(juxtaglomerular cell)(图15-13)。细胞体积较大,呈立方形,核大而圆,胞质呈弱嗜碱性,胞质内有丰富的分泌颗粒,颗粒呈PAS反应阳性。电镜下,细胞内肌丝少,粗面内质网和核糖体多,高尔基复合体发达,颗粒大小不等,多数呈均质状,用免疫组织化学法证明颗粒内含有肾素(renin)。在球旁细胞和内皮细胞之间无内弹性膜和基膜相隔,故其分泌物易释放入血,促使血管收缩,血压升高。
肾素是一种蛋白水解酶,它能使血浆中的血管紧张素原变成血管紧张素Ⅰ。后者在血管内皮细胞分泌的转换酶作用下转变为血管紧张素Ⅱ。两者均可使血管平滑肌收缩,血压升高,增强肾小体滤过作用,血管紧张素Ⅱ的作用较血管紧张素Ⅰ更强。肾素还可以促进肾上腺皮质分泌醛固酮,促进肾远曲小管和集合小管吸收Na+和排出K+,同时伴有水的进一步重吸收,导致血容量增大,血压升高。此外,球旁细胞还可能生成促红细胞生成因子,但亦有实验认为促红细胞生成因子存在于足细胞内或毛细血管内皮细胞内,故促红细胞生成因子的肾内形成部位尚待进一步证实。球旁细胞主要分布在入球微动脉壁中,但也可出现于出球微动脉壁内,尤其在肾素生成增强时,细胞内颗粒也明显增多,球旁细胞数量增多,甚至可出现在小叶间动脉等处。近年研究发现,体内其他脏器和组织亦能产生肾素。
2.致密斑远端小管直部靠近肾小体侧的上皮细胞增高,变窄,形成一个椭圆形斑,称致密斑(macula densa)。细胞呈高柱状,胞质色浅,核椭圆形,排列紧密,位近细胞顶部(图15-3,15-13)。致密斑基膜常不完整,细胞基部有细小而分支的突起,并可与邻近细胞的突起镶嵌,故与邻近细胞关系密切。致密斑细胞间有细胞间隙,细胞表面缺乏酸性糖蛋白,故致密斑是髓袢升支中唯一能通透水的上皮区,使之成为传递“信息”的场所。因此,致密斑可视为一种离子感受器,能敏锐地感受远端小管内滤液的Na+浓度变化。当滤液内Na+浓度降低时,致密斑细胞将“信息”传递给球旁细胞和球外系膜细胞,促进球旁细胞分泌肾素,增强远端小管储Na+排K+作用。
3.球外系膜细胞 球外系膜细胞(extraglonerular mesangial cell)又称极垫细胞(polar cushion cell)。是位于血管极三角区内的一群细胞,细胞形态结构与球内系膜细胞相似,并与球内系膜相延续(图15-13)。球外系膜细胞与球旁细胞、球内系膜细胞之间有缝隙连接,因此认为它在球旁复合体功能活动中,可能起“信息”传递作用。

图15-13 肾小体和球旁复合体模式图
(四)肾间质
肾泌尿小管之间的少量结缔组织为肾间质。皮质内的结缔组织少,愈接近肾乳头结缔组织愈多。肾间质中除一般结缔组织成分外,尚有一种特殊的细胞,称为间质细胞(interstitial cell)。细胞呈星形,有较长突起,胞质内除含较多的细胞器外,还有许多嗜锇颗粒。间质细胞具有分泌前列腺素和形成间质内的纤维和基质的功能,细胞突起内微丝的收缩作用,可促进肾间质血管内的血液流动。
(五)肾的血管、淋巴管和神经
1.肾的血管肾脉直接由腹主动脉分出,经肾门入肾后分为数支叶间动脉,在肾柱内上行至皮质与髓质交界处,横行分支为弓形动脉。弓形动脉分出若干小叶间动脉,呈放射状走行于皮质迷路内(图15-14)。直达被膜下形成毛细血管网。小叶间动脉沿途向两侧分出许多入球微动脉进入肾小体,形成血管球。再汇合成出球微动脉。浅表肾单位的出球微动脉离开肾小体后,又分支形成球后毛细血管网,分布在肾小管周围。毛细血管网依次汇合成小叶间静脉,弓形静脉和叶间静脉,它们与相应动脉伴行,最后形成肾静脉出肾。髓旁肾单位的出球微动脉不仅形成球后毛细血管网,而且还发出若干直小动脉直行降入髓质,而后在髓质的不同深度,又返折直行上升为直小静脉,构成“U”形直血管袢,与肾单位袢伴行(图15-14),故血管袢与肾单位袢的功能关系密切(表15-2)。
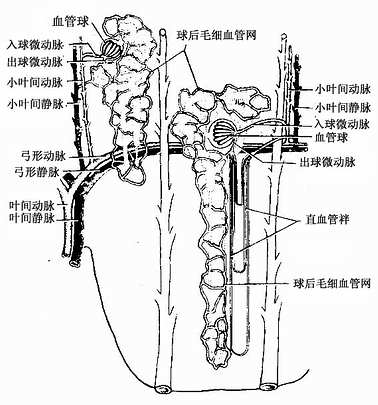
15-14 肾血液循环模式图
表15-2 肾的血循环
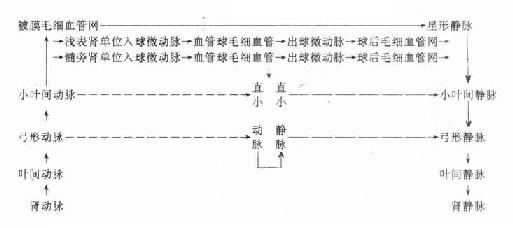
肾血液循环与肾的泌尿功能密切相关,其特点是①肾动脉直接起于腹主动脉,短而粗,血流量大,约占心输出量的1/4,即每4~5分钟人体内的血液全部流经肾内而被滤过。②肾小体血管球的毛细血管两端皆为微动脉,入球微动脉管径比出球微动脉粗,使血管球内血流量大,血压高,有利于滤过。出球微动脉的平滑肌收缩可主动调节血管球内的血压。③肾内血管通路中出现两次毛细血管,即血管球毛细血管和球后毛细血管网,由于血流经血管球时大量水份被滤出,因此分布在肾小管周围的球后毛细血管内血液的胶体渗透压甚高,有利于肾小管上皮细胞重吸收的物质进入血流。④髓质内直小血管袢与髓袢伴行,有利于肾小管和集合小管的重吸收和尿液浓缩。⑤肾内不同区域的血流不同,皮质血流量大,流速快,髓质血流量小,仅占肾血流量的10%,流速亦慢。在急性肾功能衰竭时常由于小叶间动脉发生痉挛收缩,致使皮质浅部供血减少甚至中断,大量血液流经髓质直小血管袢短路循环,致使浅表肾单位的肾小体滤过功能严重低下,甚致缺血性坏死,患者出现少尿,甚至无尿等急性肾功能衰竭症状。
2.肾的淋巴管和神经肾有两组淋巴丛,即肾内淋巴丛和被膜淋巴丛。肾内的毛细淋巴管分布在肾小体和肾小管周围,沿血管逐级汇成小叶间、弓形和叶间淋巴管,经肾门淋巴管出肾。被膜内的毛细淋巴管,汇合而成淋巴管,或与肾内淋巴丛吻合,或汇入邻近器官的淋巴管。
肾的神经来自肾丛,包括交感神经和副交感神经,神经纤维伴随肾脉入肾,分布于肾血管、肾间质和球旁复合体。
(六)肾的其他功能
肾能分泌多种生物活性物质,这些物质对机体生理活动起重要的调节作用。前已述及的肾素-血管紧张素系统,对维持机体正常血及离子交换有重要调节作用。肾皮质内的肾小管上皮可产生激肽释放酶,集合小管上皮能产生激肽。激肽释放酶能促使激肽的形成,激肽有利尿、利钾作用,并能使小动脉舒张,增加肾血流量。肾内的激肽释放酶-激肽系统与肾素-血管紧张素系统及肾间质细胞分泌的前列腺素,三者生理作用有相互关联的复杂关系。肾内产生的红细胞生成因子,能使血液中的红细胞生成素原转变为红细胞生成素,加速红细胞生成。肾还有活化维生素D3及灭活甲状旁腺素、胃泌素和胰岛素等作用。