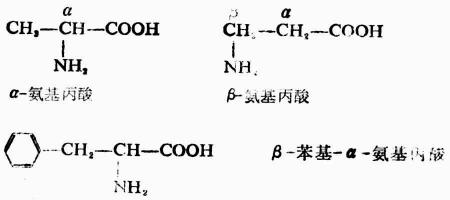
 由蛋白质水解所得到的α-氨基酸,可用通式表示如下:
由蛋白质水解所得到的α-氨基酸,可用通式表示如下:第三节 氨基酸
氨基酸是一类具有特殊重要意义的化合物。因为它们中许多是与生命活动密切相关的蛋白质的基本组成单位,是人体必不可少的物质,有些则直接用作药物。
α-氨基酸是蛋白质的基本组成单位。蛋白质在酸、碱或酶的作用下,能逐步水解成比较简单的分子,最终产物是各种不同的α-氨基酸。水解过程可表示如下:
蛋白质→月示→胨→多肽→二肽→α-氨基酸
由蛋白质水解所得到的α-氨基酸共有20多种,各种蛋白质中所含氨基酸的种类和数量都各不相同。有些氨基酸在人体内不能合成,只能依靠食物供给,这种氨基酸叫做必需氨基酸(见表18-3,*)。
一、氨基酸的构造、构型及分类、命名
(一)氨基酸的构造和构型
分子中含有氨基和羧基的化合物,叫做氨基酸。
 由蛋白质水解所得到的α-氨基酸,可用通式表示如下:
由蛋白质水解所得到的α-氨基酸,可用通式表示如下:
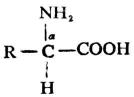 除甘氨酸(R=H)外,所有α-氨基酸中的α碳原子均是手性碳,故有D型与L型两种构型。天然氨基酸均为L-氨基酸。
除甘氨酸(R=H)外,所有α-氨基酸中的α碳原子均是手性碳,故有D型与L型两种构型。天然氨基酸均为L-氨基酸。

L-氨基酸
(二)α-氨基酸的分类和命名
氨基酸有脂肪族氨基酸、芳香族氨基酸和杂环氨基酸。
在α-氨基酸分子中可以含多个氨基和多个羧基,而且氨基和羧基的数目不一定相等。因此,天然存在的α-氨基酸常根据其分子中所含氨基和羧基的数目分为中性氨基酸、碱性氨基酸和酸性氨基酸。所谓中性氨基酸是指分子中氨基和羧基的数目相等的一类氨基酸。但氨基的碱性和羧基的酸性不是完全相当的,所以它们并不是真正中性的物质,只能说它们近乎中性。分子中氨基的数目多于羧基时呈现碱性,称为碱性氨基酸;反之,氨基的数目少于羧基时呈现酸性,称为酸性氨基酸。
氨基酸的系统命名方法与羟基酸一样,但天然氨基酸常根据其来源或性质多用俗名。例如胱氨酸是因它最先来自尿结石;甘氨酸是由于它具有甜味而得名(见表18-3)。
表18-3 常见的α-氨基酸
| 氨 基 酸 | 构 造 式 | 代号 | 常用符号 | pI |
| 甘氨酸(α-氨基乙酸) | 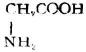 |
甘 | Giy | 5.97 |
| 丙氨酸(α-氨基丙酸) | 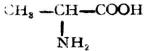 |
丙 | Ala | 6.02 |
| 缬氨酸(β-甲基-α-氨基丁酸) | 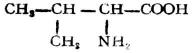 |
缬 | Val | 5.96 |
| 亮氨酸(γ-甲基-α-氨基戊酸) | 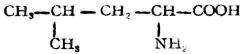 |
亮 | Len | 5.98 |
| 异亮氨酸(β-甲基-α-氨基戊酸) | 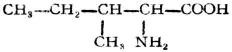 |
异 | Lle | 6.02 |
| 脯氨酸(α-羧基四氢吡咯) | 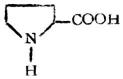 |
脯 | Pro | 6.30 |
| 苯丙氨酸(β-苯基-α-氨基丙酸) | 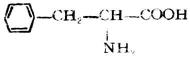 |
苯 | Phe | 5.48 |
| 色氨酸[α-氨基-β-(3-吲哚基)丙酸] | 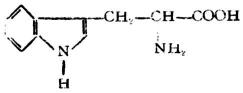 |
色 | Try (Trp) | 5.89 |
| 蛋氨酸(α-氨基-γ-甲硫基丁酸) | 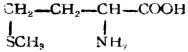 |
蛋 | Met | 5.74 |
| 丝氨酸(α-氨酸-β-羟基西丙酸) |  |
丝 | Ser | 5.68 |
| 苏氨酸(α-氨基-β-羟基丁酸) | 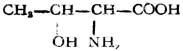 |
苏 | Thr | 6.18 |
| 半胱氨酸(α-氨基-β-巯基丙酸) | 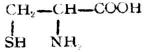 |
半 | Cys | 5.07 |
| 酪氨酸[α-氨基-β-(对羟苯基)丙酸] | 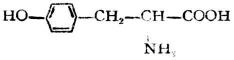 |
酪 | Tyr | 5.66 |
| 天门冬酰胺(α-氨基丁酰胺酸) |  |
天酰 | Asn | 5.41 |
| 谷氨酰胺(α-氨基戊酰胺酸) | 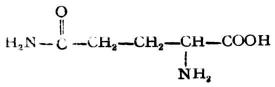 |
谷酰 | Gln | 5.65 |
| 天门冬氨酸(α-氨基丁二酸) | 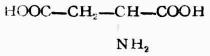 |
天 | Asp | 2.77 |
| 谷氨酸(α-氨基戊二酸) | 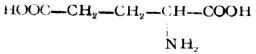 |
谷 | Glu | 3.22 |
| 赖氨酸(α,ε-二氨基已酸) | 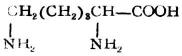 |
赖 | Lys | 9.74 |
| 组氨酸[(α-氨基-β-(4-噗唑基)丙酸] | 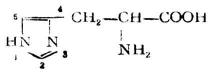 |
组 | His | 7.59 |
| 傅氨酸(α-氨基,δ-胍基戊酸) |  |
精 | Arg | 10.76 |
二、氨基酸的性质>
α-氨基酸都是无色晶体,熔点一般都较高(常在230-300℃之间),熔融时即分解放出二氧化碳。
α-氨基酸都能溶于酸性或碱性溶液中,但难溶于乙醚等有机溶剂。在纯水中各种氨基酸的溶解度差异较大,加乙醇能使许多氨基酸从水溶液中沉淀析出。
(二)化学性质
氨基酸分子内既含有氨基又含有羧基,因此它们具有氨基和羧基的典型性质。但是,由于两种官能团在分子内的相互影响,又具有一些特殊的性质。
1.两性
氨基酸分子中既有碱性-NH2和酸性-COOH,与强酸或强碱都能作用生成盐,因此氨基酸为两性化合物。
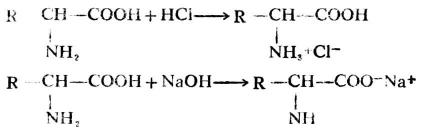 同时,在同一分子内,氨基和羧基也可作用生成盐,这种盐叫内盐。
同时,在同一分子内,氨基和羧基也可作用生成盐,这种盐叫内盐。
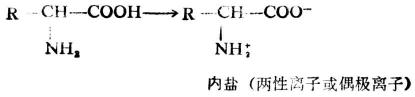 氨基酸在纯水溶液及固态时都以内盐的形式存在。在一般情况下,氨基酸中羧基的电离程度和氨基的电离程度并不相等。因此纯净氨基酸的水溶液并不一定是中性。在中性氨基酸溶液中,由于羧基的电离程度稍大于氨基的电离度,故它的水溶液的PH值一般略小于7。酸性氨基酸水溶液的PH值小于7;碱性氨基酸水溶液的PH值则大于7。但须注意,无论是何种α-氨基酸,其水溶液中两性离子都占绝对多数。
氨基酸在纯水溶液及固态时都以内盐的形式存在。在一般情况下,氨基酸中羧基的电离程度和氨基的电离程度并不相等。因此纯净氨基酸的水溶液并不一定是中性。在中性氨基酸溶液中,由于羧基的电离程度稍大于氨基的电离度,故它的水溶液的PH值一般略小于7。酸性氨基酸水溶液的PH值小于7;碱性氨基酸水溶液的PH值则大于7。但须注意,无论是何种α-氨基酸,其水溶液中两性离子都占绝对多数。
2.等电点
若将氨基酸的水溶液酸化,则两性离子与H+结合而成阳离子,若加碱于氨基酸的水溶液中,则两性离子中氮原子上的一个氢离子与OH-结合成水,而两性离子变成阴离子。
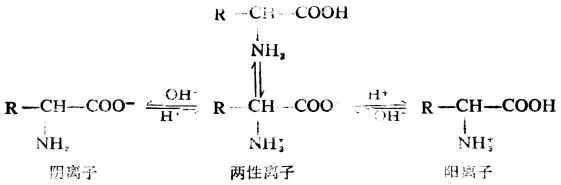
若将氨基酸水溶液的酸碱度加以适当调节,可使羧基与氨基的电离程度相等,也就是氨基酸带有正、负电荷数目恰好相同,此时溶液的PH值称为该氨基酸的等电点,以PI表示。由于各种氨基酸分子中所含基团不同,所以每一个氨基酸中氨基和羧基的电离程度各异,因此不同的氨基酸等电点亦不同(表18-3)。中性氨基酸的等电点一般在5.0-6.5之间;酸性氨基酸为2.7-3.2,碱性氨基酸为9.5-10.7。
如果在不同的PH值的氨基酸溶液中通以直流电,当PH>PI(到一定程度)时,由于氨基酸主要以阴离子存在,它们就向阳极移动;若PH<PI(到一定程度)时,因氨基酸主要以阳离子存在,则它们就向阳极移动;如果PH=PI,则不发生电泳,因为这时的氨基酸主要以两性离子存在,其净电荷为零,故在电场中不会向任何一极移动。所以,电泳是可以用来分离子或鉴定氨基酸、蛋白质等的混合物的一种技术,也可作为医学诊断的手段。
3.脱水生成肽
两分子α-氨基酸(相同或不同)可借一个分子中的羧基和另一分子中的氨基脱去一分子水,缩合成为一个简单的肽,即二肽。
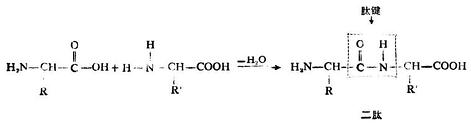 二肽分子中含有的酰胺键
二肽分子中含有的酰胺键 叫做肽键。二肽分子中的末其端
叫做肽键。二肽分子中的末其端
仍含有自由的氨基和羧基,因此还可以继续与氨基酸缩合成为三肽、四肽以至多肽。
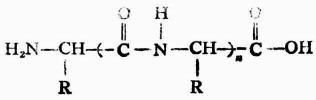
多肽
多肽类物质在天然界中存在很多,它们在生物体中起着各种不同的作用。例如,存在于大部分细胞中的谷胱甘肽(三肽),参与细胞的氧化还原过程。
4.脱羧作用
某些氨基酸在一定条件下,可脱去羧基,生成相应的胺。
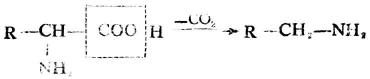 脱羧反应是人体内氨基酸代谢的形式之一,例如在肠道细菌作用下,组氨酸可脱羧生成组胺。
脱羧反应是人体内氨基酸代谢的形式之一,例如在肠道细菌作用下,组氨酸可脱羧生成组胺。
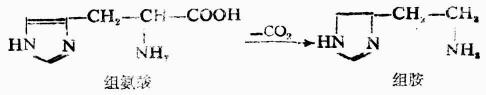 脱羧反应也可在蛋白质腐败时发生。例如在某些细菌作用下,蛋白质中的赖氨酸可变成毒性很强的尸胺(戊二胺)。
脱羧反应也可在蛋白质腐败时发生。例如在某些细菌作用下,蛋白质中的赖氨酸可变成毒性很强的尸胺(戊二胺)。
 5.与亚硝酸的反应
5.与亚硝酸的反应
氨基酸中的氨基具有伯胺的性质,与亚硝酸作用时生成羟基酸,同时定量的放出氮气。
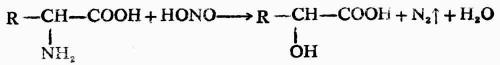 6.与茚三酮的显色反应
6.与茚三酮的显色反应
α-氨基酸与茚三酮的水合物在水溶液中加热时,生成蓝紫色或紫色化合物,同时产生醛、二氧化碳和氨。这个反应非常灵敏,是鉴定氨基酸最迅速、最简单的方法,常用于α-氨基酸的比色测定或纸层析、薄层层析时的显色。
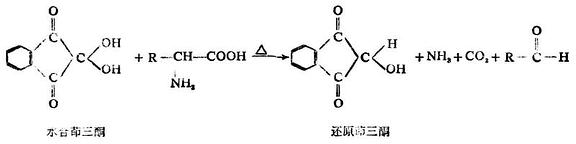
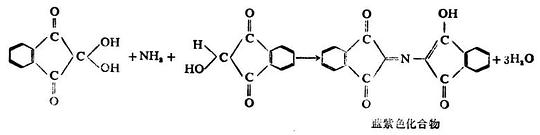 多肽和蛋白质也有此显色反应。
多肽和蛋白质也有此显色反应。