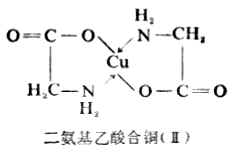
 四原子环在螯合物中是不常见的,六原子以上的环也是比较少的。中心离子有一定的电荷数,同时也有一定的配位数。Cu(Ⅱ)带有二个正电荷,它的配位数为4。氨基乙酸根离子(H2N-CH2-COO-)既有氨基氮,都能给出电子对;氨基氮能满足中心离子的配位数,羟基氧则能使配位数和电荷数同时得到满足,因此Cu 2+和两个(H2N-CH2-COO-)螯合后,得到的是中性分子二氨基乙酸合铜(Ⅱ)(简称氨基乙酸酮)[Cu(H2N-CH2-COO)2]由于羟基氧带有负电荷,故它与Cu 2+形成的配键通常用“-”表示。
四原子环在螯合物中是不常见的,六原子以上的环也是比较少的。中心离子有一定的电荷数,同时也有一定的配位数。Cu(Ⅱ)带有二个正电荷,它的配位数为4。氨基乙酸根离子(H2N-CH2-COO-)既有氨基氮,都能给出电子对;氨基氮能满足中心离子的配位数,羟基氧则能使配位数和电荷数同时得到满足,因此Cu 2+和两个(H2N-CH2-COO-)螯合后,得到的是中性分子二氨基乙酸合铜(Ⅱ)(简称氨基乙酸酮)[Cu(H2N-CH2-COO)2]由于羟基氧带有负电荷,故它与Cu 2+形成的配键通常用“-”表示。第四节 螯合物(内络合物)
一、螯合物的概念
螯合物又称内络合物,是螯合物形成体(中心离子)和某些合乎一定条件的螯合剂(配位体)配合而成具有环状结构的配合物。“螯合”即成环的意思,犹如螃蟹的两个螯把形成体(中心离子)钳住似的,故叫螯合物。
形成螯合物的第一个条件是螯合剂必须有两个或两个以上都能给出电子对的配位原子(主要是N,O,S等原子)。第二个条件是每两个能给出电子对的配位原子,必须隔着两个或三个其他原子,因为只有这样,才可以形成稳定的五原子环或六原子环。例如,在氨基乙酸根离子(H2N-CH2-COO-)中,给出电子的羟基氧和氨基氮之间,隔着两个碳原子,因此它可以形成稳定的具有五原子环的化合物。
 四原子环在螯合物中是不常见的,六原子以上的环也是比较少的。中心离子有一定的电荷数,同时也有一定的配位数。Cu(Ⅱ)带有二个正电荷,它的配位数为4。氨基乙酸根离子(H2N-CH2-COO-)既有氨基氮,都能给出电子对;氨基氮能满足中心离子的配位数,羟基氧则能使配位数和电荷数同时得到满足,因此Cu 2+和两个(H2N-CH2-COO-)螯合后,得到的是中性分子二氨基乙酸合铜(Ⅱ)(简称氨基乙酸酮)[Cu(H2N-CH2-COO)2]由于羟基氧带有负电荷,故它与Cu 2+形成的配键通常用“-”表示。
四原子环在螯合物中是不常见的,六原子以上的环也是比较少的。中心离子有一定的电荷数,同时也有一定的配位数。Cu(Ⅱ)带有二个正电荷,它的配位数为4。氨基乙酸根离子(H2N-CH2-COO-)既有氨基氮,都能给出电子对;氨基氮能满足中心离子的配位数,羟基氧则能使配位数和电荷数同时得到满足,因此Cu 2+和两个(H2N-CH2-COO-)螯合后,得到的是中性分子二氨基乙酸合铜(Ⅱ)(简称氨基乙酸酮)[Cu(H2N-CH2-COO)2]由于羟基氧带有负电荷,故它与Cu 2+形成的配键通常用“-”表示。
螯合物的特殊稳定性是环形结构带给它们的特征之一。环愈多使螯合物愈稳定。通常所说的“螯合反应”就是指由于螯合而使化合物具有特殊的稳定性。
由于螯合物的特殊稳定性,已很少能反映金属离子在未螯合前的性质。金属离子在形成螯合物后,在颜色、氧化还原稳定性、溶解度及晶形等性质发生了巨大的变化。很多金属螯合物具有特征性的颜色,而且这些螯合物可以溶解于有机溶剂中。利用这些特点,可以进行沉淀、溶剂萃取分离、比色定量等分析分离工作。
二、螯合剂
常用的螯合剂是氨螯合剂,是一类似以氨基二乙酸[HN(CH2COOH)2]为基体的螯合剂,它以N,O为螯合原子,与金属离子螯合时形成环状的螯合物
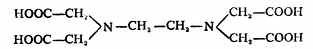
常用的氨羧螯合剂有:
氨羧螯合剂Ⅰ(ATA)指的是氨三乙酸,它的结构是:

氨羧螯合剂Ⅱ(EDTA)指的是乙二胺四乙酸。它的结构是:

乙二胺四乙酸是四元酸,如果用Y表示它的酸根,则乙二胺四乙酸可以简写成H4Y。
由于乙二胺四乙酸在水中的溶解度比较小,而其二钠盐在水中的溶解度却比较大。因些在实际应用中人们常采用EDTA二钠盐。EDTA二钠盐含有2分子结晶水,它的结构是:

EDTA二钠盐有时也叫做EDTAⅢ。但习惯上仍把它叫做EDTA。用简式Na2H2Y·2H2O表示它。
EDTA是四元酸,它在水中是分步离解的:
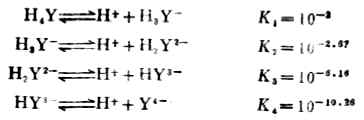
除碱金属离子外,EDTA几乎能与所有的金属离子形成稳定的金属螯合物。并且,在一般情况下,不论金属离子是几价,1个金属离子都能与1个EDTA酸根(Y4-)形成可溶性的稳定螯合物。例如:
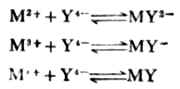
式中M表示金属离子,右上角的数字和符号表示离子的离子价。
虽然,除碱金属离子外,各金属离子大多数能与EDTA形成螯合物,但它们的稳定性差别很大。
EDTA是应用最广的一种氨羧螯合剂,用EDTA标准液可以滴定几十种金属离子,这个方法就称EDTA滴定法。目前所谓螯合滴定法主要是指EDTA滴定。
三、螯合物在医学上的应用
螯合物在自然界存在得比较广泛,并且对生命现象有着重要的作用。例如,血红素就是一种含铁的螯合物,它在人体内起着送氧的作用。
维生素B12是含钴的螯合物,对恶性贫血有防治作用。胰岛素是含锌的螯合物,对调节体内的物质代谢(尤其是糖类代谢)有重要作用。有些螯合剂可用作重金属(Pb2+,Pt2+,Cd2+,Hg2+)中毒的解毒剂。如二巯基丙醇或EDTA二钠盐等可治疗金属中毒。因为它们能和有毒金属离子形成稳定的螯合物,水溶性螯合物可以从肾脏排出。
有些药物本身就是螯合物。例如,有些用于治疗疾病的某些金属离子,因其毒性,刺激性、难吸收性等不适合临床应用,将它们变成螯合物后就可以降低其毒性和刺激性,帮助吸收。
另外在生化检验、药物分析、环境监测等方面也经常用到螯合物。