第二节 基因治疗的方法
1.基因转移方法
(1)特异正常基因的分离与克隆:应用重组DNA和分子克隆技术结合基因定位研究成果,已有不少基因并将会有更多人类基因被分离和克隆,这是基因治疗的前提,在当代分子生物技术条件下,一般来说,只要有基因探针和准确的基因定位,任何基因都可被克隆。除此,现在既可人工合成DNA探针,还可用DNA合成仪在体外人工合成基因,这些都是在基因治疗前,分离克隆特异基因的有利条件。
(2)外源基因的转移:基因转移(gene transfer)是将外源基因导入细胞内,其转移方法较多,常用的要有下列几类:
1)化学法:将正常基因DNA(及其拷贝)与带电荷物质和磷酸钙、DEAE-葡萄糖或与若干脂类混合,形成沉淀的DNA微细颗粒,直接倾入培养基中与细胞接触,由于钙离子有促进DNA透过细胞有作用,某些化合物可扰乱细胞膜,故可将DNA输入细胞内,并整合于受体细胞的基因组中,在适当的条件下,整合基因得以表达,细胞亦可传代。这种方法简单,但效率极低,一般1000-100000个细胞中只有一个细胞可结合导入的外源基因。要达到治疗目的,就需要从病人获得大量所需的受体细胞。当然,可以通过选择培养的方法来提高转化率。
2)物理法:包括电穿孔法和直接显微注射法。
①电穿孔法:电穿孔法(electroporotion)是将细胞置于高压脉冲电场中,通过电击使细胞产生可逆性的穿孔,周围基质中的DNA可渗进细胞,但有时也会使细胞受到严重损伤。
②显微注射法:显微注射(microinjection)是在显微镜直视下,向细胞核内直接注射外源基因,这种方法应是有效的。但一次只能注射一个细胞,工作耗力费时。此法用于生殖细胞时,有效率可达10%。直接用于体细胞却很困难。在动物实验中,应用这种方法将目的基因注入生殖细胞,使之表达而传代,这样的动物就称为转基因动物,目前成功使用得较多的是转基因小鼠(transgenic mice),它可作为繁殖大量后代的疾病动物模型。
③脂质体法:脂质体(liposome)法是应用人工脂质体包装外源基因,再与靶细胞融合,或直接注入病灶组织,使之表达。
3)同源重组法:同源重组(homologous recombination)是将外源基因定位导入受体细胞的染色体上,在该座位因有同源序列,通过单一或双交换,新基因片段替换有缺陷的片段,达到修正缺陷基因的目的。如在新基因片段旁组装一Neo基因,则在同源重组后,因有Neo基因,可在含有新霉素(neomycin)的培养基中生长,从而使未插入新基因片段的细胞死亡。对于体细胞基因治疗,体外培养细胞的时间不能过长,筛选量大,故在临床上应用也受限制难以进行。今后如能改进技术,提高重组率,这种定点修正基因的方法仍是有前景的。
4)病毒介导基因转移:前述的化学和物理方法都是通过传染方式基因转移。病毒介导基因转移(viral mediated gene transfer)是通过转换方式完成基因转移,即以病毒为载体(vector),将外源目的基因通过基因重组技术,将其组装于病毒上,让这种重组病毒去感染受体宿主细胞,这种病毒称为病毒运载体(viral vector)。目前应用的有两种病毒介导基因转移方法。
①反转录病毒载体:反转录病毒虽是RNA病毒,但有反转录酶,可使RNA转录为DNA,再整合到宿主细胞基因组。反转录病毒载体有以下的优点首先是具有穿透细胞的能力,可使近100%的受体细胞被感染,转化细胞效率高;其次,它能感染广谱动物物种和细胞类型而无严格的组织特异性;再者随机整俣的病毒可长期存留,一般无害于细胞,但也存在缺点:这种载体只能把其DNA整合到能旺盛分裂细胞的染色体,而不适合于那些不能正常分裂的细胞,如神经元。最严重的问题是由于病毒自身含有病毒蛋白及癌基因,就有使宿主细胞感染病毒和致癌的危险性。因此,人们有目的地将病毒基因及其癌基因除去,仅留它们的外壳蛋白,以保留其穿透细胞的功能,试图避免上述缺点。这种改造后的病毒称为缺陷型病毒(defective virus)。这样的病毒中的反转录酶可将RNA转化为DNA,有助于该DNA顺利进入宿主细胞的基因组,而该病毒则死亡。由于病毒整合基因组是随机的,所以还是可能激活细胞的原癌基因,以及因随机插入发生插入突变。
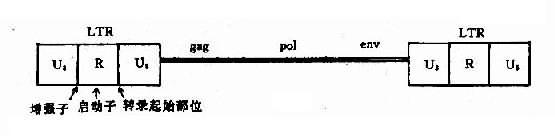
在反转录病毒载体中,最常用于人类的是莫洛尼(Mooney)鼠白血病病毒(murine leukemia virus;Mo-MLV),其人工构建的结构如图14-1。
②DNA病毒介导载体(DNA viral mekiated vector):DNA病毒包括腺病毒、SV40、牛乳头瘤病毒、疱疹病毒等,一般认为这类病毒难于改造成缺陷型病毒,实用意义不大,但

图14-1 Mo-MLV结构示意图
LTR:长末端重复序列,内含启动子、增强子及有关调节顺序;gag:病毒核心抗原基因;
env:病毒外壳蛋白基因;pol:反转录酶基因
牛乳头瘤病毒重组后,可不插入宿主染色体中引起插入突变,又可在宿主染色体外独立复制,并表达出基因产物。有人发现,因缺少E1区而致复制缺陷的腺病毒,可在表达E1基因的细胞中繁殖。后来证明,载有外源DNA的复制缺陷腺病毒呈现相同繁殖的特点。1993年美法等国成功采用腺病毒载体进行心、脑、肺、肝内胆管和肌肉组织的体内基因转移。它代表了基因治疗的新方向。图14-2是人的外源基因包装在缺陷型反转录病毒中,感染细胞经培养后再输入病人进行治疗的模式图。
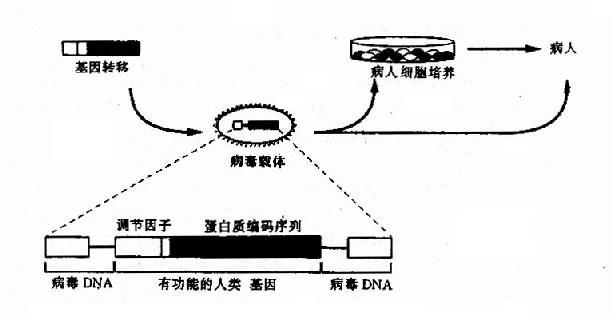
图14-2 人的外源基因包装在缺陷型反转录病毒中感染细胞
经培养后再输入病人体内进行治疗模式图
最近,美国设计了一个新的腺病症载体(图14-3),它是用一个化学连接器即赖氨酸链(lysine chain)将DNA栓在病毒外壳上,这样组成的运输器,通过一个表面抗体而进入细胞核,使宿主基因与治疗基因共同表达。这个新病毒载体称为腺病毒多赖氨酸DNA复合体(adeno virus-polylysine DNA-complex)。
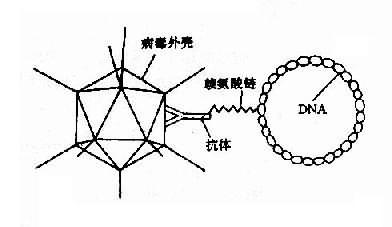
图14-3 腺病毒赖氨酸DNA复合体
采用复制缺陷的腺病毒进行基因治疗有以下优点:①该病毒可感染分裂和非分裂的细胞,并能得到大量基因产物,对神经细胞、心肌细胞等基因缺陷的纠正有特殊意义;②病毒颗粒相对稳定,并易于纯化和浓缩,且感染力不降低;③可有效转导多种靶细胞后而少游离于细胞基因组外,并持续表达;④已用于基因治疗的Ad5属腺病毒C亚群,无致癌性。前述的新腺病毒载体还有一大优点是可以成功地运载48000bp的基因,而其它病毒只能运输70 00bp的基因。这些优点显示了腺病毒介导载体的广阔应用前景。
2.靶细胞:这里所指的靶细胞是指接受转移基因的体细胞。选择靶细胞的原则是:①必须较坚固,足以耐受处理,并易于由人体分离又便于输回体内;②具有增殖优势,生命周期长,能存活几月至几年,最后可延续至病人的整个生命期;③易于受外源遗传物质的转化;④在选用反转录病毒载体时,目的基因表达最好具有组织特异性的细胞。目前使用得较多的是骨髓干细胞、皮肤成纤维细胞、肝细胞、血管内皮细胞和肌细胞等。许多遗传病与造血细胞有关,故可用于如β地贫、严重复合免疫缺陷病等的基因治疗。皮肤成纤维细胞易于移植和从体内分离,又可在培养中生长,并易存活,故有人用之于乙型血友病的基因治疗。有不少遗传病表现了肝细胞功能缺陷,因此,在家族性高胆固醇血症的治疗中,有将低密度脂蛋白(LDL)受体基因转移至肝细胞的尝试。在动物实验中已证明:β-半乳糖苷酶基因、ADA基因、小肌营养不良蛋白(minidystrophin)基因都已证明能在肌细胞中表达。