第八章 免疫细胞(二):淋巴细胞系
淋巴细胞是具有特异免疫识别功能的细胞系,人和哺乳类动物的淋巴细胞系是由形态相似、功能各异的不均一细胞群所组成。按其个体发生、表面分子和功能的不同,可将淋巴细胞系分为T细胞和B细胞二个亚群,每个亚群又可分为不同的亚类。另外还有一群单核细胞,其来源可能与淋巴细胞相关,但不具有特别识别功能,称为天然杀伤细胞(natural killer cell,NK)可归类为第三群淋巴细胞。
成熟的T和B细胞均为单核的小淋巴细胞。在光学显微镜下,单纯从形态学是能加以区别的。但在它们的细胞膜上都有不同的分子结构,包括膜抗原分子和膜受体分子。这些表面标志都是结合在膜上的巨蛋白分子,可用不同的方法检测,借以鉴定和区分淋巴细胞系的不同亚群和亚类。
研究这些膜分子的结构与功能将有助于了解淋巴细胞活化的机制。研究这些膜分子基因的表达与调控,对了解淋巴细胞的起源、分化与成熟都具有十分重要的理论意义。并且在淋巴细胞的分类、诊断与相关疾病的治疗及发病学等方面都具有应用意义。
第一节 T细胞
一、T细胞主要表面分子
T细胞是由一群功能不同的异质性淋巴细胞组成,由于它在胸腺内分化成熟故称为T细胞。成熟T细胞由胸腺迁出,移居于周围淋巴组织中淋巴节的副皮质区和脾白髓小动脉的周围。不同功能成熟的T细胞均属小淋巴细胞,在形态学上不能区分,但可借其细胞膜表面分子不同加以鉴别(表8-1)。
在T细胞发育不同阶段以及成熟T细胞在静止期和活化期,其细胞膜分子表达的种类和数量均不相同。这些分子为抗原性不同的糖蛋白。它们与T细胞对抗原的识别、细胞的活化、信息的传递、细胞的增殖和分化以及T细胞的功能表达相关。它们也与T细胞在周围淋巴组织中的定位相关。
由于这些分子在T细胞表面相当稳定,故可视为T细胞的表面标志,可以用以分离。鉴定不同功能的T细胞。这些分子的单克隆抗体对临床相关疾病的诊断和治疗也具有重要应用价值。
表8-1 T细胞主要表面分子
| 名称 | 生化特性 | 配体 | 功 能 粘附 信号传导 |
| TCR | αβ异二聚γδ异二聚体 | MHC-肽复合分子 | + + |
| CD3 | 五聚体 | - | - + |
| CD4 | 单体分子 | MHCⅡ类分子 | + + |
| CD8 | 双体分子 | MHCⅠ类分子 | + + |
| CD28 | 同二聚体分子 | B7/BB1 | + + |
| CD2(LFA-2) | 单体分子 | CD58(LFA-3) | + + |
| CD11α/CD18 (LFA-1) |
αβ异二聚体分子 | CD54 (ICAM-1) (ICAM-2) |
+ + |
| CDw49/CD29 (VLA-4、5、6) |
αβ异二聚体分子 | VCAM-1 | + ? |
| CD44)(Pgp-1) | 单体分子 | ECM | + + |
| CD45 | 单体分子 | ? | ? + |
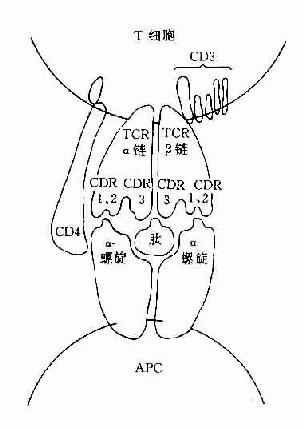
(一)T细胞抗原识别受体(TCR)
1.TCRαβ TCR是T细胞识别蛋白抗原的特异性受体,不同的T细胞克隆其抗原识别受体的分子结构也是不相同的。大多数成熟T细胞(约占95%)的TCR分子是由α和β二条异二聚体肽链组成的TCRαβ分子。二条肽链都由膜外区、穿膜区及胞浆区组成。TCR属于Ig超家族,膜外区可包括可变区(V区)及稳定区(C区)。
编码人TCRα链和β链基因座分别定位于第14号和7号染色体。α链是由V、J、C基因段编码的肽链。每个基因座又各有不同的等位基因,在T细胞发育分化早期与Ig基因一样经历基因重排、转录和转译成为肽链。TCR的特异性是由α链和β链的V-J及V-D-J基因片段决定的,故二条链基因重排后可形成千万种不同特异性的TCR分子,故可识别环境中多种多样的抗原。在通常情况下,异种蛋白抗原分子必须与细胞表面的自身MHC分子结合才能TCR识别。所以TCR只能识别细胞膜上的MHC分子与抗原分子,这是与B细胞识别原的主要不同特性。
2.TCRγδ另一种TCR是由γ和δ链组成的TCRγδ分子,它是由γ和δ基因编码的分子。这种TCRγδ细胞多见一胸腺内早期T细胞(CD4-,CD8-,TCRγδ+),而在人周围血成熟T细胞(CD3+,TCRγδ+)中所占的比例甚少,约为1%~10%。在小鼠脾、表皮细胞和肠粘膜上皮细胞中亦可发现γδ+T细胞。对这种新发现的T细胞的生理功能尚不不清楚,但它们可能是具有原始受体的第一防线的防御细胞,与清除表皮及上皮细胞内异物有关,它们可能是具有原始受体的第一防线的防御细胞,与清除表皮及上皮细胞内异物有关。它们可识别高度保守的抗原,如结核杆菌、肠毒素和热休克蛋白等抗原,在人和小鼠均表明它们可识别MHC或MHC样分子。
(二)CD3分子
此分子可表达于所有成熟T细胞表面,它是由五条肽链非共价结合组成的复合分子,分别称为γ、δ、ε、ζ和η链。五条肽链均由胞外区、穿膜区和胞浆区组成。γ、δ和ε为单体,ζ和η链其胞外区可由双硫键连接组成为同二聚体ζζ(约占90%)和异二聚体ζη分子(约占10%)。

图8-1 TCR识别普通抗原
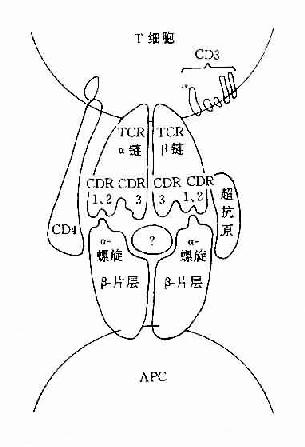
图8-2TCR识别超抗原
CD3分子可与TCR分子以非共价结合形成一个TCR-CD3复合受体分子,是T细胞识别抗原的主要识别单位。其中TCR是识别异种抗原和自身MHC分子多态性决定族的受体,而CD3分子交不参予抗原识别,它具有稳定TCR结构和传递活化信号的作用。
(三)CD4和CD8分子
这二种分子可同时表达于胸腺内早期胸腺细胞,称为双阳性胸腺细胞(CD4+、CD8+,DP)。而在成熟T细胞这二种分子是互相排斥的,只能表达一种分子,故可将成熟T细胞分为二类,即CD4+细胞和CD8+细胞。在外周淋巴组织中CD4+T约占65%,CD8+T约占35%。
这二种分子同属于Ig超家族,都不具有多样性。其分子结构都由胸外区、穿膜区及胸内区组成。CD4分子为55KD的单体,CD8分子为34KD多肽组成的双体分子。
这二种分子与抗原识别无关,但可与带有MHC分子的细胞结合,它们是细胞与细胞间相互作用的粘附分子。CD4分子是MHCⅡ类分子的受体,它可与MHCⅡ类分子的非多态区结合。CD8分子可与MHCⅠ类分子的非多态区结合。因此这二种分子具有增强TCR与抗原呈递细胞或靶细胞的亲和性,并有助于激活信号的传递。
(四)CD28分子
这种分子可表达于全部CD4+T细胞及50%CD8+细胞。它是80~90KD的由双硫键连接的同源二聚体分子,属Ig基因超家族。
近年的研究证明T细胞的活化需要双信号,即由TCR-CD3复合分子可提供起始信号或第1信号,还必须有协同刺激信号(costimulatouy signal)或第2信号才能使T细胞活化。在T细胞膜上已发现有多种分子与协同刺激信号产生有关,如CD2、LFA-1、VLA-4及CD28分子等。称这种分子为辅助分子或协同刺激受体分子。
其中以CD28分子最为重要,已证明它的配体分子存在于B细胞或其它抗原呈递细胞上,命名为B7或BB1分子。它是50KD单体分子的穿膜蛋白,也属Ig基因超家族。B7/BB1分子在静止期B细胞、巨噬细胞或树突状细胞等表达弱,而活化型细胞表达增强。
(五)CD2分子
此分子亦称为LFA-2、Len-5或羊红细胞受体等名称。为55KD单体分子,属Ig基因超家族,亦为穿膜糖蛋白分子。可存在于成熟T细胞及胸腺细胞,亦可发现于NK细胞。
CD2分子是细胞间粘附分子,其配体分子称为白细胞功能相关抗原-3(LFA-3,CD58),为55-70KD糖蛋白分子。可广泛表达于造血细胞和非造血细胞。CD2分子与羊红细胞上LFA-3结合形成花环,称为E-花环,可用鉴定和分离人T细胞。
CD2也是信号传导分子,可使T细胞活化,它不依赖于TCR途径,是T细胞活化第二途径。特别是在胸腺内早期发育阶段的胸腺细胞尚未表达TCR,此时胸腺细胞的活化与增殖可能是通过CD2分子与胸腺上皮细胞表面的LFA-3分子结合而使之活化。
(六)极迟活化分子
极迟活化分子(very late activation,VLA)或称β1粘合素(β1integrins),本族分子具有共同的β链(CD29),计有3种分子即VLA-4、VLA-5和VLA-6分子。它们可表达于静止T细胞上,但活化T细胞有仅数量增多而且对特异配体的亲和力也增强。VLA分子可与细胞外基质(ECM)配体分子相结合,可为T细胞活化提供协同刺激信号。VLA-4还可使淋巴细胞与Peyer小体的高内皮微静脉以及炎症部位的内皮细胞结合,其配体分子称为血管细胞粘附分子-1(VCAM-1)。
(七)细胞因子受体
细胞因子受体(cytokine receptor,CKR)可表达于静止及活化T细胞表面,静止T细胞表面的细胞因子受体亲和力弱,数量少,而活化T细胞表面CKR亲和力高且数量多。
T细胞表面可有多种细胞因子受体,包括IL-2R、IL-4R、IL-6R及IL-7R等。其中IL-2R由α(P55)及β(P70)链组成,α链为低亲和力,β链为中等亲和力,而αβ异聚体分子则为高亲和力受体。
(八)CD44及CD45分子
CD44分子亦称Pgp-1细胞外基质受体Ⅲ或Hermes分子。它可表达于多种细胞,包括T细胞、胸腺细胞、B细胞、粒细胞、巨噬细胞、红细胞、神经细胞、上皮及纤维母细胞等。CD44分子可使淋巴细胞与高内皮微静脉(HEV)结合,移行于血管,组织和淋巴之间,与淋巴细胞再循环密切相关,可视为一种归巢受体(homing receptor,HR)。人记忆T细胞比未受体抗原刺激的天然T细胞可表达高水平CD44分子。
CD45分子亦称白细胞共同抗原(leukocyte common antigen)包括一组膜糖蛋白,只表达于不成熟和成熟白细胞,可包括T和B细胞、胸腺细胞、单核-巨噬细胞以及中性粒细胞。CD45分子的异构体(isofoums)常限定在某些T细胞表面表达,故称之为CD45R。
未受抗原刺激的天然T细胞可表达CD45RA,而记忆T细胞可表达CD45RO。另外,CD45R分子胞浆区含有内源性酪氨酸磷酸酶活性,它可能对各种活化途径具有重要调节作用。
二、T细胞亚群的分类及功能
T细胞是不均一的群体,按其抗原识别受体,可将T细胞分为二大类。一类是TCRαβ、T细胞,另一类是TCRγδ细胞(表8-2)。
表8-2 TCRαβ+T细胞与TCRγδT细胞的特性
| TCRαβT细胞 | TCRγδT细胞 | |
| 分子结构 | 二硫键相连的异二聚体分子 | 二硫键相连的异二聚体分子 |
| 多样性 | 多 | 少 |
| 分布 | 周围血60%~70% | 周围血1%~10%表皮及肠粘膜上皮 |
| 表型 | CD4+CD8+(DP)60% CD4-CD8-(DN)35% CD2+100% CD5+>95% |
CD4-CD8-(DN) CD2+ CD5- |
| 发育 | 胸腺(发生晚) | 胸腺(发生早)存在胸腺外途径 |
| 功能 | 识别与MHC分子结合的多肽复合 分子抗原 |
可能的作用 |
TCRαβT细胞也是不均一的群体,根据其表型(phenotype)即其细胞表面的特征性分子的不同,可将成熟T细胞分为二个亚类(subsets)即CD4+T细胞和CD8+细胞。
根据TCRαβT细胞的功能可将其分为二类。一类为调节性T细胞,可包括辅助性T细胞(helper T lymphocte,TH)和抑制性T细胞(suppressor T lymphocyte,Ts)。另一类为效应性T细胞(effector T cell),可包括杀伤性T细胞(eytolytie T cell,CTL,或TC)和迟发型超敏性T细胞(delayed type hypersensitivity T lymphoctye,TDTH)。
(一)TCRαβT细胞
二类T细胞表型分子均呈CD2+、CD3+阳性,但γδT细胞为CD4-、CD8-双阴性细胞(double negative cell,DN)或CD8+,而αβT细胞其表型为CD4+或CD8+单阳性细胞(single positive cell,SP)。
在末梢血主要为αβT细胞可占95%,而γδT细胞只占1%~10%。αβT细胞为主要参予免疫应答的T细胞,而对γδT细胞功能不十分了解,可能是具有原始受体的第一防线的防御细胞,与抗原感染有关。
(二)CD4+细胞
TCRαβTCD4+细胞(简称为CD4+细胞)的分子表型为CD2+、CD3+、CD4+、CD8-。其TCR识别抗原是MHCⅡ类分子限制性。CD4+T细胞也是不均一的细胞群,按其功能可包括二种T细胞,即辅助性T细胞(TH),和迟发型超敏性T细胞(TDTH)。前者为调节性T细胞,后者为效应性T细胞。
CD4+T细胞能促进B细胞、T细胞和其它免疫细胞的增殖与分化,协调免疫细胞间的相互作用。T细胞在静止状态不产生细胞因子,活化后才能产生。
近年来,根据建立的小鼠TH细胞克隆,分析其产生的细胞因子种类,发现具有不同的调节功能,可将TH细胞分为二类,即TH1和TH2(表8-3)。TH1与细胞免疫及迟发型超敏性炎症形成有关,故亦称为炎症性T细胞,相发于TDTH细胞。TDTH细胞。TH2可辅助B细胞分化为抗体分泌细胞,与体液免疫相关,相当于TH细胞。
表8-3 小鼠TH1及TH2特性
| 特性 | TH1(炎症性T,Tinf) |
TH2(辅助性T,TH) |
| 功能 | ||
| Ig产生 | + | ++ |
| B细胞增殖 | + | ++ |
| 迟发型超敏性(DTH) | ++ | - |
| 细胞毒性(CTL) | ++ | - |
| MФ活化 | + | + |
| 细胞因子 | ||
| IL-2 | ++ | - |
| IFN-γ | ++ | - |
| TNF-β | ++ | - |
| IL-3 | ++ | ++ |
| GM-CSF | + | ++ |
| TNF-α | + | ++ |
| IL-4 | - | ++ |
| IL-5 | - | ++ |
| IL-6 | - | ++ |
| IL-10 | - | ++ |
| 细胞因子受体 | ||
| IL-1 | - | ++ |
| IL-2 | ++ | ++ |
| IL-4 | + | ++ |
近年一些学者在过敏性疾病的患者及健康人末硝血中也建立了人TH1和TH2克隆,也证实了在人也存在TH1和TH2细胞(表8-4)。这二类细胞是互相制约的,它们的失调与感染性疾病以及自身免疫性疾病相关。
(三)CD8+T细胞
CD8+T细胞也是不均一的细胞群,按其功能可包括抑制性T细胞(TS)和杀伤性T细胞(TC),前者为调节性T细胞,后者为效应性T细胞。
1.TC细胞 杀伤T细胞(TC)其分子表型为CD2+、CD3+、CD4+、CD8+。其TCRαβ只能识别自己MHCⅠ类分子与抗原肽片段结合的复合分子,所以是MHCⅠ类分子限制性。TC细胞主要识别存在于靶细胞表面上的MHCⅠ类分子与抗原结合的复合物,如被病毒感染的靶细胞或癌细胞等。因此,TC效应细胞与抗原病毒免疫、抗肿瘤免疫以及对移植物的移植排斥反应有关。
表8-4 人TH1及TH2特性
| 特性 | TH1 | TH2 |
| 细胞因子 | ||
| IL-2 | + | ± |
| IFN-γ- | + | - |
| IL-4 | - | + |
| IL-5 | - | + |
| 辅助功能 | ||
| IgG/IgA/IgM产生 | + | ++ |
| IgE产生 | - | + |
| 细胞毒性 | + | - |
| 抗原反应性 | ||
| TT.PPD | + | - |
| 变应原 | - | + |
注:TT,破伤风类毒素;PPD:纯化结核菌素
2.Ts细胞 Ts细胞是一类与TH细胞和Tc细胞性质不同的淋巴细胞。Ts细胞是美国学者Gershon于70年代在小鼠体内证明它的存在。他是给小鼠经静脉注射大剂量抗原(羊红细胞)则小鼠呈现不应答状态即耐受状态。如果把这种耐受小鼠的淋巴细胞,注入正常同基因小鼠同素小鼠体内,可抑制其抗体产生。其后证明这种具有抑制作用的淋巴细胞是Thy-1+T细胞,故称这种细胞为Ts细胞。
现已证明,人Ts细胞的分子表型与Tc相同,也是CD2+、CD3+、CD4+、CD8+。它的功能是抑制免疫应答的活化期。Ts细胞的抑制作用是通过它所分泌的抑制因子(TSF)介导的,其作用的靶细胞是抗原特异的TH和或B细胞。
Ts细胞可发挥两种重要作用,首先它对在胸腺内不能形成自身耐受的自身反应性T细胞克隆有抑制作用,同时它对非已抗原透发的免疫应答也有抑制作用。实验证明,Ts细胞功能变化是引起各种免疫功能异常的重要原因之一。
由于对Ts细胞的研究进展缓慢,尚有许多疑问有待解决。这主要是因为尚不能获得较大量的纯化Ts细胞,对建立稳定的Ts细胞克隆以及建立具有特异抑制活性的Ts杂交瘤均未获成功。因此,对Ts细胞的一些基本问题,如Ts细胞抗原识别受体(TCR)的性质及其分泌的抑制因子(TSF)的特性等问题,均有待明确。故目前尚不能描述它们的分子结构及作用方式。
Ts细胞是否是一种独立的T细胞功能亚类,学者间还存在很大争论,今后必需证明它的TCR性质和找出其独特的表面标志,才能解决这一问题。
(四)CD45RA与CD45ROT细胞
近年应用单克隆抗体发现一组新的细胞膜表面分子,命名为CD45分子。它可广泛存在于造血系细胞膜表面,故也称之为白细胞共同抗原(leukocyte common antigen,LCA),分子量约为200KD的糖蛋白分子。根据其胞外区表位的不同已发现有6种异构体分子,在人已鉴定出3种异构体分子,即CD45RA、CD45RB和CD45RO。应用这种异构体分子可将T细胞分为二个新亚群。凡未经抗原刺激的T细胞可称之为原始T细胞(naive t cell,Tn)为CD45RA+T细胞群,而经抗原刺激分化为记忆T细胞(memory T cell,Tm)为CD45RO+细胞群,二群T细胞功能特性不同(表8-5)。
表8-5 Tn与Tm特性
| 特性 | Tn | Tm |
| CD45 | CD45RA | CD45RO |
| 归巢受休表达 | 高水平 | 低水平 |
| 粘附分子表达 | 低水平 | 高水平 |
| 再循环 | 血流→淋巴组织 | 直接移行至抗原部位 |
| 寿命 | 短(数目) | 长(数月) |
| 再次抗原刺激 | - | +++ |
T细胞可随血流及淋巴分布于体内各部位,在正常情况下,T细胞在周围组织中的数目是相对稳定的。如在胸导管淋巴液中可占90%,在脾中约占30%,淋巴节中约占75%,末梢血中可占60%~80%。CD4+和CD8+细胞的比例,在周围各组织中大致相同,即CD4+约占60%,CD8+约占30%。CD8+的比值在正常人约为2,若其比值<1.0或>2.0可视调节细胞(TH/TS)比例异常,与临床一些疾病相关。可应用抗各种表型抗原的单克隆抗体检测全T细胞的数量及其亚类((TH/TS)的比值,常有助于疾病的诊断。
三、T细胞在胸腺内的发育
在一个体内能特异识别各种抗原的T细胞总数称之为T细胞库(T cell repertoire),成熟的T细胞库具有二种基本特性。其一为T细胞识别抗原是MHC限制性的,即每一个体的T细胞只能识别与其自身MHC分子结合的异种抗原分子。另一特性为T细胞库对自己抗原是耐受性的,即每一个体的T细胞不能单独识别自己MHC分子或是与之结合的自己抗原分子,即所谓自身耐受现象。
如果不能维持自身耐受,将导致发生抗自己组织抗原的免疫应答和自身免疫性疾病。所以了解成熟T细胞库是如何发育形成的,不仅对了解T细胞特异性的产生是重要的,而且有助于揭示自身免疫病的致病机制。
胸腺是T细胞发育成熟的主要部位,故称之为中枢免疫器官。胸腺微环境为T细胞发育分化创造了条件。对T细胞发育细胞发育分化的研究主要是在小鼠体内进行的,并由此推论至人类。
(一)胸腺微环境
胸腺微环境主要由胸腺基质细胞(thymic stroma cell,TSC)细胞外基质(extracellular matrix,ECM),和细胞因子等组成。当T祖细胞(pro-T)自胚肝或骨髓进入胸腺后,在胸腺微环境作用下,可诱导其发育分化。在其分化成熟过程中,可先后发生各种分化抗原的表达,各种细胞受体的表达,并通过正和负选择过程,最终形成T细胞库。最后成熟T细胞被迁移出胸腺,并定居于周围淋巴器官,参于淋巴细胞再循环,可分布于全身组织等一系列复杂过程。
1.胸腺基质细胞胸腺基质细胞可包括起源于胸腺胚基内胚层的上皮细胞和来源于骨髓的巨噬细胞、树突状细胞(dendritic cell,DC)、纤维母细胞、网织细胞和肥大细胞等。在基质细胞中以上皮细胞数量最多、分布最广,可分为皮质上皮细胞和髓质上皮细胞。它们在T细胞分化不同阶段都起重要作用,上皮细胞主要与正选择过程相关,而巨噬细胞等则与负选择过程相关。
2.细胞外基质 T细胞在胸腺内的发育是由皮质向髓质移行的过程中完成的。在此过程发育中的T细胞即胸腺细胞需与胸腺基质细胞直接相互接触,或是通过细胞外基质介导二种细胞间接触,因此ECM在T细胞的分化发育中也起重要作用。现已确定的细胞外基质有胶原蛋白(collegen),网状纤维、葡糖胺以及一些糖蛋白如纤维粘连素(fibronectin,FN),层粘连蛋白(laminin,LN)等。
3.细胞因子胸腺细胞和胸腺基质细胞都能分泌细胞因子,并都有一些细胞因子受体,可相互调节胸腺细胞与胸腺基质细胞的分化发育和维持胸腺微环境的稳定(表8-6)。
表8-6 胸腺细胞和上皮细胞产生的细胞因子及受体
| 细胞因子 | 细胞因子受体 | |||
| 胸腺细胞 | 上皮细胞 | 胸腺细胞 | 上皮细胞 | |
| IL-1 | + | + | + | + |
| IL-2 | + | - | + | + |
| IL-3 | + | + | - | - |
| IL-4 | + | - | + | + |
| IL-6 | + | + | + | + |
| IL-7 | + | + | + | + |
| IL-8 | - | + | - | - |
| IFNγ | + | - | + | + |
| IFNα | + | + | + | + |
| TGFα | - | - | - | + |
| GM-CSF | - | + | - | - |
| M-CSF | - | + | - | - |
| G-CSF | - | + | - | - |
(二)T细胞在胸腺内的发育过程
通过对小鼠T细胞发育的研究表明,当来自胚肝或骨髓的T祖细胞(pro-t)进入胸腺后,可经历不同的发育阶段,其TCRαβ、CD3以及协同受体CD4和CD8等分子的表达水平不同,是受高度调节的发育过程。
实验证明,小鼠T细胞在胸腺内的分化发育可分为三个阶段:即早期T发育为双阴性细胞阶段,其主要表型为CD4-和CD8-,故称为双阴性细胞(DN)。第二阶段为不成熟胸腺细胞,即由DN细胞经单阳性细胞(CD4-、CD8+、)进而分化为双阳性(CD4+、CD8+、)细胞(double positive,DP)。第三阶段为由DP细胞经正、负选择过程,分化发育为具有免疫功能的成熟T细胞,只表达CD4+或CD8+,故称为单阳性细胞(single positive,SP),然后迁出胸腺,移居于周围淋巴器官。
上述四群细胞都是不均一的群体,而且由一个分化阶段发育为另一阶段还有许多移行型细胞,因此对T细胞发育的了解尚有许多问题需待进一步深入研究。
1.早期T细胞发育阶段由胚或骨髓干细胞衍生的T细胞进入胸腺后经前T细胞(pre-T)发育为双阴性细胞,这一过程可视为早期T细胞发育阶段。
Pro-T细胞(表型为CD410、CD3-、CD8+、CD25-、C-kit+、Lin-、TCRαβ-)通过其表面粘附分子与胸腺毛细胞血管内皮细胞上的配体分子结合,并在上皮细胞分泌的多种趋化因子作用下,穿过血胸屏障进入胸腺。在皮质区进行增殖和分化,经Pre-T(表型为CD3-、CD4-、CD8-、CD25-、C-kit10,其TCRβ及γ基因发生重排及转录)进一步发育为DN细胞(其表型为CD3+、CD4-、CD8-、CD25-、TCRαβ-),但其TCRβ-βCD3可表达于细胞表面,与基质细胞配基结合后,经p56lek传导信号,诱导CD4/CD8分子表达及TCRβ基因发生等位排斥。由此使T细胞发育进入DP阶段,并发生胸腺内的选择过程,最终发育为单阳性(SP)的成熟T细胞库。
2.胸腺选择过程 主要发生于DP阶段,此时TCRαβ基因重排、转录及表达,形成TCRαβ-CD3复合分子,并具有识别配基(自已MHC分子+自己抗原分子)的功能。DP细胞与不同胸腺基质细胞(TSC)相互作用,可导致不同的结果。
胸腺细胞经选择作用后,能存活或被排除,基于它们TCRαβ的特异性,决定于TCR与MHC分子的结合和在胸腺内表达的抗原分子。阳性选择过程可使能自己MHC分子限制性的T细胞克隆增殖,产生功能性成熟T细胞;而阴性选择过程,可使对自己抗原反应性T细胞克隆被排除或不应答,形成自身免疫耐受(表8-7,图8-3)。这是二个顺序过程,提示阳性选择可能发生在阴性选择之前。
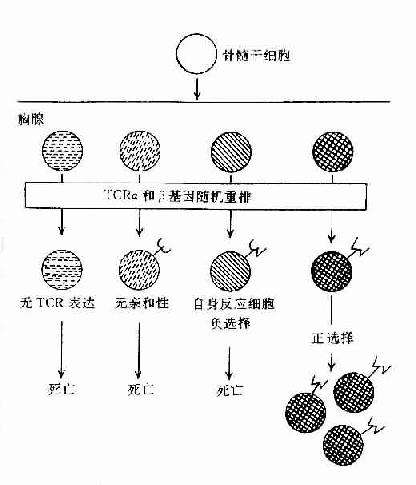
图8-3胸腺内TCR特异选择
1)阳性选择(positive selection,PS):主要发生在DP细胞与皮质型上皮细胞之间的相互作用。凡TCR与自已MHc 分子有亲和性的胸腺细胞可与之结合并导致克隆增殖,而无亲和性的胸腺细胞将导致死亡。在此过程中大部分DP细胞死亡,只有小部分DP细胞存活并增殖。此过程可排除所有非已MHC限制性T细胞克隆,保存自己MHC限制性T细胞克隆和潜在的有害的自身反应性T细胞克隆。此过程可使DP细胞分化为SP细胞。
2)阴性选择(negative selection,NS):主要发生于DP细胞与胸腺内巨噬细胞(MФ),树突状细胞(DC)或髓质上皮细胞间的相互作用。胸腺细胞TCR与存在于上述细胞上自己抗原与自己MHC复合物有高亲和性者结合,可导致自身反应性T细胞克隆死亡并被排除,称之为克隆排除(clonal deletion)或克隆存在但受抑制不能活化,称之为克隆不应答(clonal anergy)。现已证明克隆排除与细胞程序性死亡(PCDD)相关,克隆不应答与缺乏活化信号相关,称这种耐受为中枢耐受。但不在胸腺表达的自己抗原,其自身的反应性T细胞仍能发育成熟,并漏出周围淋巴组织,可能由Ts细胞抑制其活性,导致周围自身耐受,所以自身耐受的形成是由多种机制完成的。经胸腺阴性选择作用后,排除了自身反应性T细胞克隆,只有识别非已抗原与自已MHC分子结合的T细胞克隆存活,并由DP细胞分化为具有功能的单阳生(SP)细胞(CD4+或CD8+T细胞)。所以成熟T细胞库表现为自己MHC限制性和自己耐受二种特征。
表8-7 胸腺内阳性/阴性选择
| 胸腺外组织(胚肝,骨髓) | T祖细胞(progenitor-T,Pro-T) |
| 胸腺皮质 | ↓ CD4-CD8-(DN) ↓ CD4+CD8+(DP) ↓ 阳性选择 获得自己MHC限制性 CD4+ CD8+(SP) (自身反应与非自身反应性克隆) |
| 胸腺髓质 | 阴性选择↓排除自反性克隆或不应答(自己耐受) CD4+ CD8+ (MHCⅡ限制TH) (MHCⅠ限制性TC) |
| 周围淋巴组织 | CD4+ CD8+ (TCRαβ) (TCRαβ) |