二、HLA与器官、骨髓移植
移植免疫与免疫遗传有着密切的联系,当今器官、骨髓移植的成活率大大提高主要归功于(1)免疫遗传学理论和技术的发展;(2)强有力的免疫抑制药如环发孢素A(cyclosprinA,CsA)和FK506。
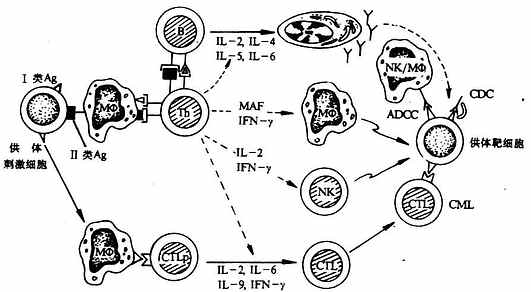
前已所述,移植排斥反应的本质是一种免疫应答,移植物细胞表面HLa I类和Ⅱ类抗原都是强移植抗原,体液免疫和细胞免疫都参与了对移植物的排斥反应(图6-23)。移植排斥反应可分为三个阶段。
(1)致敏阶段:移植和抗原激发受者的免疫应作主要通过两个形式。①移植物释放出可溶性抗原或脱落的细胞碎片,随淋巴或血液到邻近或远处的淋巴组织,经过受者的抗原提呈细胞处理后,刺激并活化受者的免疫活性细胞。②受者外周血循环中的免疫细胞流经移植物时可接受移植物细胞表面移植抗原的刺激而致敏,被致敏的淋巴细胞在局部或再循环到淋巴组织中增殖。Ⅱ类抗在主要来自未能灌洗干净脏器(肾、心)中微循环中B细胞等(又称过路细胞passenger cells)以及皮肤上皮细胞。I类抗原存在更为广泛。
(2)增殖反应阶段:供体和移植抗原刺激受体的Th细胞发生增殖,并产生IL-2、IL-4、IL-5、IL-6、IL-9和IFN-γ等多种细胞因子,为B细胞和杀伤性T细胞前体(CTLp)增殖和分化提供条件,并促进Mφ和NK细胞的杀伤功能。HLA-I类抗原和Ⅱ类的DR、DQ抗原经巨噬细胞处理后分别刺激CTLp和B细胞,分化为效应CTL和抗体产生细胞,后者产生IgG、IgM等抗体。
(3)效应阶段:针对移植抗原的抗体通过抗体介导的细胞依赖的细胞毒作用(ADCC)或补体信赖的细胞毒作用(CDC),直接杀伤移植物细胞;CTL发挥细胞介导的溶细胞作用(CML);此外,MAF、IFN-γ和IL-2等细胞因子活化后的巨噬细胞、NK细胞可直接杀伤靶细胞。

图6-23 移植排斥反应的免疫学机制
[环孢菌素A与FK506免疫抑制剂的抗移植排斥反应的机理]环孢菌素A(cyclosporin A,CsA)是由11个氨基酸组成的环状分子 ,分子量1203,70年代初由Sandoz公司从真菌中发现。80年代日本Fujisawa公司发现的FK506为大环内酯抗生素,分子量228。CsA和FK506免疫抑制作用十分相似,其机理主要是T细胞活化过程中IL-2、IL-4、TNF-α、IFN-γ等基因的转录,抑制细胞因子合成,降低IL-2R和转铁蛋白的表达,抑制B细胞针对胸腺依赖抗原的抗体形成。CsA和FK506分别与作用靶细胞内环亲和素和FK506结合蛋白(FK506binding protein,FKBP)结合形成复合体,这类复合体的靶分子为一种称之为Calcineurin Ca2+/钙调蛋白依赖性的Ser/Ther磷酯酶,使Calcineurim磷酯酶活性受到抑制,阻止活化T细胞核子(neulear factor of activated T cells,NFATC)的去磷酸化,从而阻止了NFATC向细胞核内转移,影响IL-2等基因的转录。
(二)肾脏移植和异基因骨髓移植(allo-BMT)已使数以万计的肾功能衰竭患者以及急性白血病、慢性粒细胞白血病、重症再生障碍性贫血、重症联合免疫缺陷(SCID)等患者获得新生。器官和骨髓移植的存活率与供体和受体之间的组织配型密切相关,除ABO血型相符外,HLA要相同或尽可能相近。HLAⅡ类基因的相合对于避免和减轻GVHR和肾脏等移植器官的长期存活非常重要。这是因为供者和受者HLA-Ⅱ类抗原相合或相合较好,受者的Th细胞不发生或只发生轻度活化的增殖,产生细胞因子的量不足于诱导B细胞和CTL的增殖和分化。因此在HLA-Ⅱ类抗原相合前提下,有时即使I类抗原不相合,受体不会发生明显的针对移植抗原的抗体应答和Tc的杀作用。
1.肾脏移植 1954年Murray第一次施行同卵双生姐妹之间的肾移植获得长期存活;1959年Murray在美国和Hambrager在法国各自第一次为异卵双生同胞间施行肾移植获得长期存活;1962年第一次用尸体肾进行人的异体移植获得长期存活。我国肾移植首次报道于1974年。由于分型技术和外科技术的改进,免疫抑制药物的应用以及术说输供体血,移植肾成功能率和患者存活率稳步升高。
Vredevoe(1965)报千了供者与受者间淋巴细胞抗原相容性程度与肾移植物的存活率有关。存活率由高到低的顺序是,同卵双生>同胞>亲子>无亲缘关系(表6-20)。在肾脏移植史的初期,主要检测HLA-A、B位点的抗原,以后有采用MLR配型检测D位点。由于DR与D抗原相关性很好,而且DR抗原可用血清学方法加以检测,故从1980年以来多采用检测DR抗原。Van Rood(1980)发表的欧洲移植中心的尸体肾移植HLA-A、B和DR位点抗原全部相符时,1年移植肾存活率高达89%,在HLA-DR相符而A、B有一个位点不符时,1年移植肾存活率仍高达89%,相反,如HLA-A、B位点完全相符而HLA-DR有一个不相符时移植肾1年存活率下降到70%。目前倾向于DR和B位点抗原同时检测。
表6-20 供受者HLA配型与肾移植存活率(%)的关系(举例)
| 供受者HLA配合情况 | 存活率(%) | ||
| 3年 | 5年 | 10年 | |
| 完全一致(同卵双生) | 80 | 81 | 70 |
| 一个单体型一致(父母与子女间) | 65 | 55 | 40 |
| 完全不配 | 50 | 36 | 20 |
至于尸体肾移植,在11次IHW上,Terasaki作为“用于肾移植的HLA表型匹配”的专题报告,认为简单计算HLA特异性或错配对判断尸体供肾移植成功与否意义不大。但对HLA特异性氨基酸序列分析的新知识使我们有可能寻找更具免疫原性的表位,已发现“ 构象表位”(conformational epitopes)对移植物的长期存活具有重要作用。
2.骨髓移植 骨髓移植的适应症有:(1)重症联合免疫缺损(CSID);(2)再生障碍性贫血;(4)放射病。
HLA不符,尤其是D位点不同会引起严重的移植物抗宿主反应(GVHR)。Dupout(1977)报导了第一例重严联合免疫缺陷患者经过骨髓移植重建免疫功能。患者的基因型为:A1B3D3/A1B15D4血型A,供者的表型为A1A2B8B15D4,血型AB,共移植骨髓7次。我国北京医科大学血液病研究所1981年成功地治疗了第一例白血病女性患者,由胞兄提供同种异基因骨髓,移植后半年检查患者染色体、血型和酶的类型与胞兄完全相同,达到国际上规定的骨髓持久性植活标准。
单克隆抗体的问世给骨髓移植开辟了新途径,应用单抗加补体可去除供体骨随中成熟的T淋巴细胞,而供体骨髓中的干细胞在受体内经过胸腺的受训而发育的成熟T细胞不会把受体的组织细胞作为外来物质加以排斥,可有效地防止GVHR的发生。
异基因骨髓移植受益于MHC的研究成果最为明显,经HLA相合的异基因骨髓移植已使数以万计的急性白血病、慢性粒细胞白血病、重症再生障碍性贫血、SCID、代谢性疾病等患者获得了新生。
表6-21 全球器官移植统计资料(截止1991年底)
| 移植器官 | 移植中心数 | 移植病人累计数 |
| 肾脏 | 442 | 241048 |
| 心脏 | 222 | 19445 |
| 心/肺 | 75 | 1600 |
| 肺 | 55 | 1184 |
| 肝脏 | 155 | 21324 |
| 胰腺 | 94 | 2144 |
| 肾/胰 | 72 | 2854 |
| 骨髓 | 262 | 41764 |
| 其它 | 50 | 1000 |
| 总计 | 1427 | 332363 |
表6-22 各种器官移植存活时间最长者统计表(截止1991年底)
| 移植器官 | 受者存活最长时间(年) |
| 肾 脏 | 29.5 |
| 肝 脏 | 22.5 |
| 心 脏 | 21.0 |
| 骨 髓 | 23.5 |
| 胰 腺 | 14.0 |
在器官移植方面,随着免疫抑制剂(如环孢素A)应用后排斥反应的缓解,曾一度认为选择HLA相容性供者已可有可无。然而近年对组织配型的重要性再次取得共识,特别认识到HLA-Ⅱ类基因包括DP的相容性对移植器官存活仍是极为重要的,对骨髓移植避免GVHR尤为如此。但由于HLA多态性,Ⅰ类和Ⅱ类基因座完全相合的供受配对几乎仅见于同胞兄弟组妹之间,供者的来源相当受限。目前的解决办法有两个,一是采用单体型相同的家庭成员为供者,一是转向无血缘关系者(URD),此类DMT称为UBMT。近来年,世界范围内URD库急剧扩大,至今已有50万以上URD的HLA-A和-B的分型记录在案,其中18,000人还有一DR和-DQ分型资料。这类移植中,组织配型价值更显突出。我国推行独生子女政策,对URD库的建立似更近切。要求供/受相容性的选择精确而又快速,趋势是作DNA分型。