第二节 免疫球蛋白基因的结构和多样性
表3-2 免疫球蛋白基因定位
| 编码多肽链 | 基因符号
(人) |
基因定位(染色体) | |
| 人 | 小鼠 | ||
κ轻链 |
IGK | 2p11 | 6 |
λ轻链 |
IGL | 22q11 | 16 |
H重链 |
IGH | 14q32.3 | 12 |
免疫球蛋白(Ig)的分子由IGK、IGL和IGH基因编码。IGK、IGL和IGH基因定位于不同的染色体(表3-2)。编码一条Ig多肽链的基因是由胚系中数个分隔开的DNA片段(基因片段)经重排而形成。1965年Dreyer和Bennet首先提出假说,认为Ig的V区和C区由分隔存在的基因所编码,在淋巴细胞发育过程中这两个基因发生易位而重排在一起。1976年Hozumi和Tonegawa应用DNA重组技术证实了这一假说。
一、 Ig重链基因的结构和重排
Ig重链基因是由V、D、J和C四种不同基因片段所组成。
(一)Ig重链可变区(V区)基因
重链可变区基因是由V、D、J三种基因片段经重排后所形成。
1.重链V区基因的组成 编码重链V区基因长约1000~2000kb,包括V、D、J三组基因片段。
(1)重链V基因片段:小鼠VH基因片段数目为250~1000个。根据VH基因片段核酸序列的相似性(>80%同源性),至少可分为11个家族(family).人V基因片段约为100个,至少可分为6个家族,每个家族含有2~60个成员不等。V基因片段由2个编码区(coding regions)组成:第一个编码区编码大部分信号序列;第二个编码区编码信号序列羧基端侧的4个氨基酸残基和可变区约98个氨基酸残基,包括互补决定区1和2(complementarity determining region 1和2,CDR1和CDR2)。
(2)重链D基因片段:D(diversity)是指多样性。DH基因片段仅存在于重链基因中而不存在于轻链基因。D基因片段编码重链V区大部分CDR3。小鼠DH共有12个片段,位于VH和JH基因片段之间,大部分DH片段较为集中,约占60~80kb,但靠上游的DH可能位于VH区域内,最后一个DH片段与JH基因5'端相距约0.7kb。人类DH片段可能有10~20个左右。
(3)重链的J基因片段:J(joining)指连接,是连接V和C基因片段。JH编码约15~17个氨基酸残基,包括重链V区CDR3除DH编码外的其余部分和第4骨架区。小鼠JH基因片段有4个,与Cμ相距约6.5kb。人有9个JH,其中6个是有功能的JH基因片段。
V、D、J基因片段经重组连接在一起,组成2个外显子,一个外显子编码信号序列的大部分,另一个外显子编码信号序列的其余部分和重链可变区。
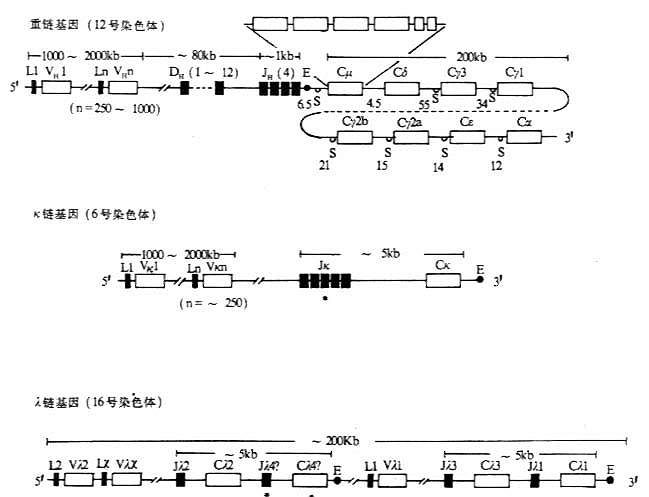
小鼠和人在胚系中Ig基因的结构见图3-4和图3-5。
2.重链可变区基因的移位 在重链基因重排开始时,二条染色体上都发生D基因片段移位到J基因片段而发生D-J基因连接。在此以后,只有其中一条染色体上的V基因片段与D-J基因片段连接。VH基因片段5'端含有启动子(promoter),JH和Cμ基因片段之间的内含子中含有转录增强子(transcriptinal enhancer)。如果一条染色体VH基因与D-J基因重排无效(non-productive),另一条染色体的VH基因片段开始发生移位,与D-J基因片段连接。
某些与Ig基因片段重排有关的特殊序列称为识别序列(recognition sequences),位于V基因片段的3'端与J基因片段的5'端之间以及D基因片段的两侧。V基因片段3'端、J基因片段5'端以及D基因片段的两侧也是DNA重排识别信号所在区域,这些识别信号包括三部分:(1)高度保守的回文结构的七聚体(palindromic heptamer);(2)较少保守、富含A/T的九聚体(nonamer);(3)七聚体和九聚体之间不保守的间隔序列(spacer sequence),含有12±1碱基对或23±1碱基对。根据12/23碱基对间隔规则(或称1圈/2圈定律),两个基因片段的重组仅发生在两个基因片段之间:各有一个12个碱基对片段和一个23个碱基对片段的结构(图3-6)。

图3-4 小鼠Ig基因结构
注:(1)L:先导序列基因片段 V:可变区基因片段 D:D基因片段
J:J基因片段 C:恒定区基因片段 E:转录增强子
S:转换区 *:假基因
(2)内含子区域所标数字表示DNA长度(kb)。
(3)每个CH基因用一个方框表示,实际上包括几个外显子,如Cμ含有6个外显子。
(4)λ基因增强子位于Cλ4和Cλ1基因片段的下游。
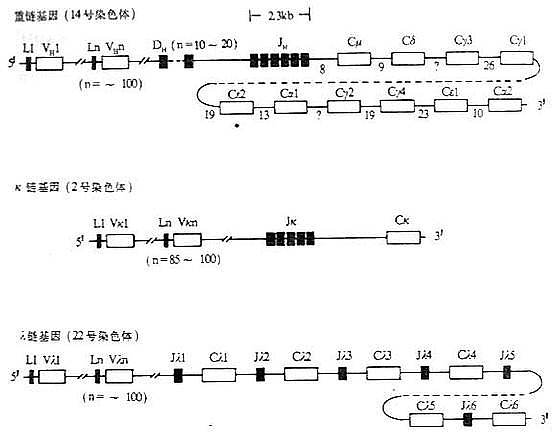
图3-5 人Ig基因结构
注:(1)L:先导序列基因片段 V:可变区基因片段 D:D基因片段
J:J基因片段 C:恒定区基因片 *:假基因
(2)内含子区域所标数字表示DNA长度(kb)
(3)每个CH基因用一个方框表示,实际上包括几个外显子
参与V/(D)/J基因重组过程的酶称为V/(D)/J重组酶(recombinase),有关于执行识别、切割和重新连接基因片段重组酶的纯化和鉴定工作还刚开始。重组酶实际上包括重组过程中多种酶的活性。最近在前B细胞(pre-b cell)中已经鉴定出两种刺激Ig基因重排的基因,称为重组激活基因1(recombination activating gene 1,RAG-1)和重组激活基因2(RAG-2),其确切的作用机理还不太清楚。重组酶作用的特点是:(1)淋巴细胞特异性的,非淋巴样细胞如成纤维细胞无重组酶活性,这可能解释了Ig基因的重排仅见于B淋巴细胞。目前一般认为T细胞TCR基因重排中的重组酶与B细胞中重组酶相同或相似。(2)重组酶发挥其功能仅限于B细胞发育早期,未成熟B细胞如前B细胞(pre-b cell)细胞系重组酶活性很高,但抗体生成细胞或骨髓瘤细胞无明显重组酶活性,因此时B细胞已经分泌某一特异性抗体,不再发生重排其它的Ig基因,因此也不会改变原先所产生抗体的特异性。转换重组酶(switch recom-binase)可能与VDJ重组酶(VDJ recombinase)相似,但缺乏七聚体/九聚体(heptamer/nonamer)识别蛋白。重组酶功能异常可导致机体不能产生Ig和TCR,很可能与重症联合免疫缺陷(severe combined immunodeficiency,SCID)的发生有关。例如SCID小鼠16号染色体着丝点末端存在一个scid基因,为单基因常染色体遗传基因。scid基因纯合将影响DNA重组酶的识别功能,在TCR或BCR基因片段重排时不能识别正确的位点,使T细胞、B细胞在淋巴干细胞发育早期即夭折,导致重症联合免疫缺陷。
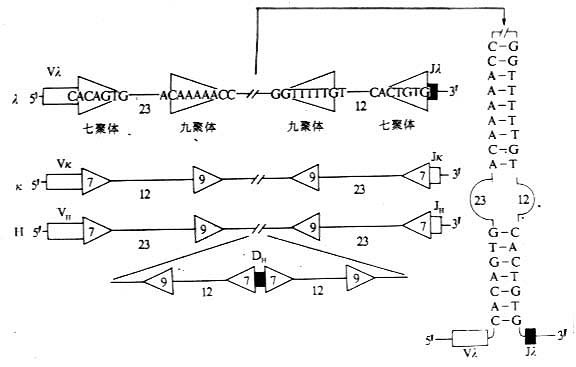
图3-6 参与Ig基因重排组酶识别的DNA序列
(二)Ig重链恒定区(C区)基因
1.重链C基因片段 重链恒定区基因由多个外显子组成,位于J基因片段的下游,至少相隔1.3kb。每1个外显子编码1个结构域(domain),铰链区(hinge region)是由单独的外显子所编码,但α重链的铰链区是由CH2外显子的5'端所编码。大多分泌的Ig重链羧基端片段或称尾端“tail piece”是由最后一个CH外显子的3'端所编码,而δ链的“tail piece”是由一个单独的外显子所编码。小鼠CH基因约占2000kb,其外显子从5'端到3'排列的顺序是Cμ-Cδ-Cγ3-Cγ1-Cγ2b-Cγ2a-Cε-Cα。人CH基因外显子排列的顺序是Cμ-Cδ-Cγ3-Cγ1-Cε2(pseudo基因)Cα1-Cγ2-Cγ4-Cε1-Cα2。其中基因片段Cγ3-Cγ1-Cε2-Cα1和基因片段Cγ2-Cγ4-Cε1-Cα2可能是一个片段经过一次复制而得,为研究CH基因的起源和进化提供有用的依据。
2.免疫球蛋白类型转换 1964年Nossal等发现B淋巴细胞存在着类型的转换。Ig类型转换(class switch)或称同种型转换(isotype switch)是指一个B淋巴细胞克隆在分化过程中VH基因片段保持不变,而发生CH基因节段的重排、比较CH基因片段重排后基因编码的产物,V区相同而C区不同,即识别抗原特异性不变,而类或亚类发生改变。这种类型转换在无明显诱因下可自发产生。
局部微环境和细胞因子可影响和调节免疫球蛋白类型的转换,如在肠道派伊尔氏结的B细胞V基因片段优先转换到Cα1进行重排,因此主要合成和分泌IgA。在体外向经LPS刺激的小鼠B细胞中加入IL-4,可促进B细胞产生IgG1和IgE,抑制IgG2b产生;低浓度的IL-4主要诱导产生IgG1,高浓度IL-4主要诱导产生IgE。面IFN-γ则诱导小鼠B细胞合成IgG2a,抑制IgE的产生。TGF-β、IL-5和IL-6对IgA的产生具有促进作用(表3-3)。细胞因子调节B细胞Ig类别转换的机理可能是:(1)刺激某些细胞的克隆选择性的增殖,使分泌某特定类、亚类抗体的克隆细胞增加,如IL-5、IL-6促进IgA。产生除通过同种型转换进行调节外,还可选择性促进IgA定向细胞分化增殖为IgA分泌细胞。(2)通过诱导特定位置上两个转换区的重组,诱导B细胞由分泌IgM向某一同种型Ig转换。如高浓度IL-4促进LPS诱导小鼠B细胞产生IgE,主要是使Cε转换区与重组酶的接近(accessibility),通过同种型转换促进IgE的产生。
表3-3 细胞因子对LPS诱导的Ig类和
亚类转换的调节作用(占总Ig%)
| 细胞因子 | IgM | IgG1 | IgG2a | IgE | IgA |
| 对照(不加外源性细胞因子) | 85 | 2 | <1 | <1 | <1 |
| IL-4 | 70 | 20 | <1 | 5 | <1 |
| IFN-γ | 80 | 2 | 10 | <1 | <1 |
| THF-β和IL-2 | 75 | 2 | <1 | <1 | 15 |
注:(1)纯化的小鼠IgM+IgD+B细胞体外培养时,加入不同的细胞因子和LPS,然后检 LPS,然后检测不同类或亚类免疫球蛋白的百分比。
(2)由于未检测所有类和亚类Ig,所以每组Ig总百分比不到或接近100%。
Ig类型转换可能通过以下两种机理。
(1)缺失模型(deletion model):又称linear orderly deletiom of H chain genes。以小鼠CH基因为例,如Cμ和Cδ基因片段被缺失,那么先前重排的VDJ就会按照顺序与下一个CH基因即Cγ3发生重排,经转录和翻译后,编码γ3重链;如缺失所有的γ链亚类基因,依次会产生ε链。上述模型在被刺激后小鼠B细胞在体外培养中产生Ig类别的顺序得到证实,即先产生IgM,然后依次产生IgG3和IgG1等。但这个模型不能解释免疫动物或抗原刺激B细胞培养中单个B细胞可同时表达几种不同类或亚类的重链。
(2)RNA的不同剪接:除DNA水平的Ig类型转换形成外,RNA水平的不同剪接(alternative RNA splicing)也可产生不同的Ig类型。 Cμ和Cδ基因片段之间无S区,IgM和IgD共表达的B细胞系DNA分析表明,Cμ和Cδ基因片段没有发生重排,相同的VH出现在μ或δ链的mRNA上,表明它们可能有一个共同的mRNA前体,通过不同的或差异剪接(differential splicing)分别形成μ链和δ链mRNA。初级RNA转录本(primary RNa transcript)是由VDJ复合体连接Cμ和Cδ基因片段经转录后形成。如果在剪接过程中切除初级RNA转录本中的Cδ部分,经加工后形成μmRNA;如去除初级RNA转录本中的Cμ部分,则加工后形成δmRNA。这两种mRNA分别被翻译,使单个B细胞同时产生μ和δ链,同时表达IgM和IgD。同样的机理可从一条长的primary RNA转录本中加工为 μmRNA和εmRNA(或其它重链mRNA),同时表达IgM、IgE或其它类Ig。
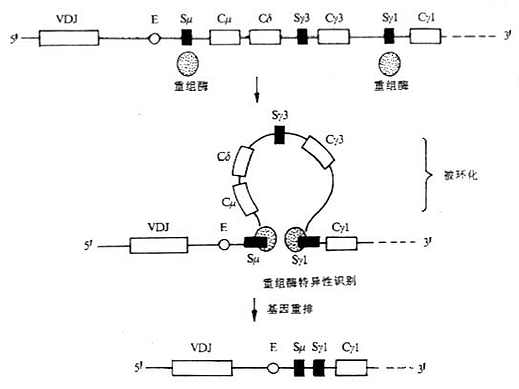
图3-7 Ig类型转换缺失模型
(三)膜表面Ig重链基因
膜表面Ig(mIg)重链基因的外显子结构与分泌性Ig重链的基因外显子结构基本相同,但在基因组的3'端有所不同。作为识别抗原受体的mIg,其重链羧基端有一段疏水性氨基酸插入到胞膜双层脂质中,mIg重链的转录本要比分泌性重链转录本多1~2个外显子,与分泌性重链基因最后一个外显子至少相隔1.4kb,这1~2个外显子编码重链的羧基端部分,这部分氨基酸残基的数目视重链不同而有所差异,如鼠或人mIgμ链的这一部分约为41个氨基酸残基,而鼠mIgε链这部分却有72个氨基酸残基。这个区域可分为三个部分:(1)一个酸性间隔子,靠氨基端侧,与最后一个CH结构域相连,位于细胞膜外侧;(2)跨膜部分,由26个不带电荷的疏水氨基酸形成一个α螺旋,穿过胞膜的脂质双层;(3)胞浆内羧基端部分,3~28个氨基酸残基不等,可能与信号传递有关。
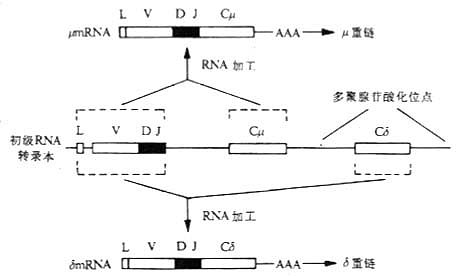
图3-8 RNA的差异拼接与IgM和IgD共同表达在一个B细胞上
分泌形式的μ、α和δ重链最后一个结构域后有一段额外延长的由带电荷氨基酸组成的序列,称为尾片(tail pieces),约含20个氨基酸,在IgM和IgA分子中,单体Ig尾片通过二硫键相互连接或与J链形成二聚体或多聚体。分泌形式μ链的mRNA含有V、D、J、Cμ1、Cμ2、Cμ3、Cμ4和Cμ43'端一个小的外显子转录区。
Ig重链基因除L、V、D、J和C基因片段外,在内含子中还有一些与mRNA转录和免疫球蛋白类的转换有关的结构。
(1)插入顺序(intervening sepuence,IS):有IS1、IS2、IS3……等。
(2)转换区序列:即S区(switch region)。除Cδ外,各个恒定区基因片段上游都有一个同源重复序列的S区,约占2~10kb,分别命名为Sμ、Sγ、Sα和Sε等,与Ig类和亚类的转换有关。S区含有众多串联的高度保守的DNA重复序列,每个重复序列可长到52bp,其确切的功能还不清楚。如Sμ的结构为[(GAGCT)nGGGGT]m,n一般为2~5,但有时可达17,m可达150。目前关于H链转换区的研究主要以小鼠为模型,如4个Sγ是由49bp长的基序的重复序列所组成。Sα至少由长为80pb的15个重复序列,Sε的重复序列长为60bp。在小鼠,B淋巴细胞经T细胞非依赖性活化后常发生Sμ/Sγ3和Sμ/Sγ2b的重组,因此在无T细胞存在条件下,LPS活化小鼠B细胞成为淋巴母细胞,主要转换Ig的亚类为IgG3和IgG2b。
(3)启动子:靠近每个V基因转录位点的上游,含有TATA盒,控制RNA多聚酶Ⅱ作用下的转录过程。大多数Ig的启动子含有许多DNA序列,包括一个保守的8个核苷酸序列,可能是核DNA结合蛋白(nuclear DNA-binding proteins)结合部位,在转录过程中起着重要作用。由于核DNA结合蛋白是由其它基因所编码,因此这种作用方式被称为反式作用(transacting).
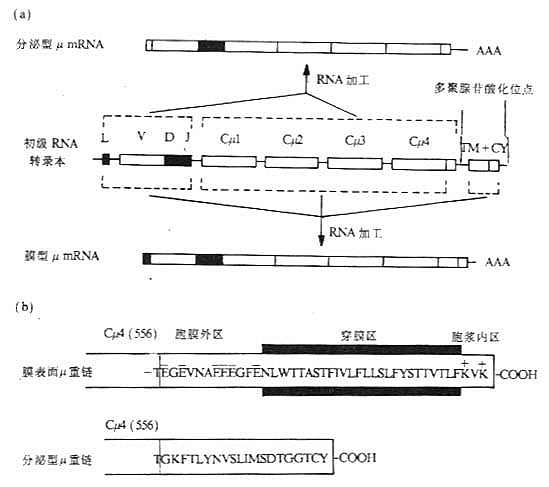
图3-9 膜表面和分泌的Igμ基因及μ链羧基端结构的比较
注:(a)初级RNA转录本通过不同的剪接加工,分别形成分泌型μmRNA和膜型μmRNA。
(b)苏氨酸(T)为Cμ4第556位氨基酸。膜表面μ重链的556氨基酸后还有41个氨基酸,其中富含带负电氨基酸胞膜外区12个氨基酸,26个疏水性氨基酸组成的穿膜区以及胞浆区3个氨基酸;分泌型μ重链在556位氨基酸后有20个氨基酸组成的尾片,C末端倒数第二个为半胱氨酸。
(4)增强子(E):在人和小鼠和重链和κ轻链中发现有增强子,其核苷酸序列为TGGTAAG。在H链基因中,增强子位于JH3'端侧。当H链VDJ或κ链VJ重排后,V基因上游的启动子靠近增强子,使V(D)JC基因重排后开始更为有效的转录。增强子作用方式与启动子不同,呈方向非依赖方式(orientation-independent manner),即增强子可作用于被转录基因的上游或下游。此外,增强子的作用是细胞特异性。
已重排Ig基因的转录起始于TATA盒下游约20核苷酸处,转录至C基因后,产生初级RNA(primary RNA)转录本,在3'端切断后进行多聚腺苷酸化(polyadenylation),剪接掉不编码的内容含子,如J区与C区之间的不编码序列是在RNA水平上被剪接掉。
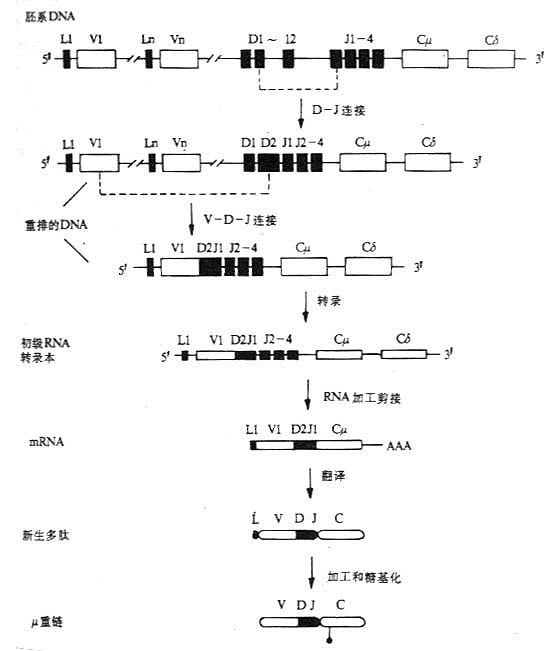
图3-10 小鼠μ链的基因重排顺序、转录和合成
(四)重链基因重排、转录和多肽链的合成。
以μ链基因的重排顺序、转录和μ链合成为例,见图3-10。