第五节 其它免疫电镜技术
一、凝集素电镜标记技术
凝集素的特性及标记原理详见第五章 ,近年来,凝集素电镜标记技术应用日益广泛,且获得较为满意的效果。凝集素电镜标记技术方法较多,常用的有凝集素—酶(常用为HRP)、凝集素—生物素—酶电镜标记技术。现将凝集素—酶电镜标记技术(包埋前染色)简介如下(Sterit 和Kreatzberg,1987)。
(1)固定:常用为PLP或多聚甲醛—戊二醛固定液。如为取脑组织,可将已藻注动物在4℃过夜,次日取脑组织置0.1mol/L磷酸或二甲胂酸钠缓冲液(含7.5%蔗糖)中漂洗。
(2)振动切片机(Vibratome)切60μm的厚片。
(3)切片孵育在PBS(内含0.1mol/l CaCl2、Mgcl2和MnCl2)10min(有作者主张此步可省略)。
(4)为增强细胞通透性,切片可孵育于含0.1%胰蛋白酶和0.1CaCl2水溶液中,pH7.8,37℃孵育30min。
(5)PBS洗3次,每次2min。
(6)凝集素—HRp 1:10 在PBS中(含0.1%Triton X--100)4℃过夜,最好不断轻轻振荡。
(7)PBS洗3次,每次2min。
(8)DAB-H2O2显色。
(9)1%OSO4水溶液固定。
(10)系列酒精脱水,EPON包埋,切片。
(11)电镜沿—铀双染观察。
凝集素呈高电子密度常沉积在细胞膜上,易与电子染色相区别。
二、扫描免疫电镜技术
扫描免疫电镜技术可为研究细胞或组织表面的三维结构与抗原组成的关系提供可能性。
(一)标记物
应用于扫描电镜的标记物应能在扫描电镜可分辨的范围内,并能对细胞或组织抗原有较好的定位能力。在选择标记物时应根据研究目的而定,如标记细胞等由于体积较大,可用体积大的标记物;如鉴别阳性(标记细胞)与阴性(未标记细胞),而要定位受体等则需选用较小的,易于辨认的标记物。
常用的标记物为颗粒性标记物。依其特性可分为:
1.蛋白类 如血蓝蛋白、铁蛋白等。
2.病原体类 如烟草花叶病毒、南方菜豆花叶病毒、噬菌体T4、大肠杆菌f2、噬菌体等。
3.金属颗粒胶体金、免疫金银标记技术和同位素放射性自显影的银颗粒等。其中以金属类颗粒标记物应用最为广泛。最常用的是胶体金,胶体金商品提供的直径从3~150nm不等,扫描免疫电镜常用的金颗粒直径在30~60nm左右为宜。由于金本身系重金属,有较强的发射2次电子的作用,故不需喷镀金属膜,这是胶体金应用于免疫扫描电镜的标记优于其它标记物之处。免疫金银染色能加强细胞或组织表面金属颗粒聚集的密度。金、银粒在电镜显示为电子密度高,外形清晰的颗粒易于识别和定位。病原体标记物主要利用其特异殊的外形和结构以达到标记定位的目的,如噬菌体T4形似星形的球拍,头部大约100nm直径,呈六角形星状,尾长约100nm,由颈部与头部相接;烟草花叶病毒为15×30nm的杆状病毒,而南方菜豆花叶病毒是直径25nm的园形颗粒,这些病原体的典型外形很易于辨认。铁蛋白由于含有致密的铁离子核心具有较高的电子密度,从而达到标记定位的目的。血蛋白是由海螺类软体动物中提取的多分子聚合物,其外形为35×50nm的柱状体,多应用于病毒研究,但也有利用血蓝蛋白与过氧化物等的糖蛋白部份可与凝集素相结合的特性,进行细胞膜受体的定位。
(二)免疫标记方法
金属类标记物的免疫标记法同切片免疫染色,即将标记物与抗体相结合,通过直接或间接法显示抗原部位。胶体金可与蛋白A相结合后与IgG分子中的Fc 段相结合。哪与卵白素(a-vidin)相结合可与结合抗体的生物素(biotin)反应。免疫金银染色法在胶体金标记后,再进行银液显影。病毒(包括噬菌体)标记物多采用不标记抗体法,即搭桥法。此法的原理是采用同种动物制备抗原的特异性抗体与标记物抗体(例如兔抗A抗原与兔抗HRP)。再用另一种动物制备第一种动物血清抗体的抗体(例如羊抗兔IgG抗体)。利用后者为桥,把抗原的特异性抗体与抗标记物抗体结合起来,后者再与标记物结合,以达到定位抗原的目的,其基本原理与PAP法类同。病原体免疫标记可不用标记物显示,而利用其形态学特征定位或采用抗原抗体凝集法,其基本原理是利用病毒或病毒抗原的特异性抗体在与相应的抗原反应后,使后者之间发生交联而凝集,经浓缩后用阴性染色法(负染)便可在电镜下显示定位部位。
(三)扫描免疫电镜的具体操作步骤
1.标本处理
(1)细胞悬液:用10ml PBS 内含1mg/ml牛血清白蛋白(PBS—BSa )悬浮细胞,离心250g,5min×2。加入PBS—BSA 至105~106细胞/ml,振摇成单细胞悬液。BSA能减低生物标本的非特异性吸附,但注意浓度应适宜,过高会减弱特异性反应。
(2)细胞附着于固体支持物:由于固定与免疫标记的孵育过程会引起细胞凝集,妨碍细胞表面的暴露,而且反复的离心与悬浮会导致细胞表面形态的改变。因此,通常将悬液中的细胞粘附于过滤膜或涂有带正电荷聚合物的盖玻片上,在粘附之前可依(1)法清洗标本,以除去细胞表面的附着物。固体支持物可用涂有多聚—L—赖氨酸薄膜的载片或直径13nm、孔径0.22或0.45μm的过滤膜,载片制备方法:多聚—L—赖氨酸(Sigma)100μg/ml重蒸溶解涂抹于载片上,4℃30min后倾倒掉表面液体,令其自然干燥。注意载玻片事先需要清洁液浸泡,水漂洗过夜,然后浸泡于乙醇或丙醇中,用前取出自然干燥或用绸巾拭干。将细胞悬液(如细胞数少可事先离心,取沉淀细胞),滴于滤膜或载片上,由于多聚赖氨酸的粘附性,在固定及免疫标记过程中细胞不至于脱落。但注意勿使细胞干燥。
(3)组织切片与固体组织:组织切片如为石蜡包埋应预先脱蜡,由二甲苯经梯度酒精至水。组织切片与固体组织(勿过大)均应以PBS—BSA冲洗,并保持湿润避免干燥。
2.固定
(1)固定前用PBS—BSA冲洗5min×3。
(2)选择加入适合的固定剂;可为4%多聚甲醛+0.1%~0.5%戊二醛在pH7.4的磷酸缓冲液中。室温固定10~60min,或4℃30~120min。
(3)PBS—BSA冲洗5min×3。
(4)除去残留的自由醛基,选以下任一方法:
①0.5mg硼氢化钠/1ml PBS 10min(新鲜配制)
②0.05~0.2mol/l 甘氨醊或赖氨酸—HCl/PBs 30~60min。
③0.1~0.5mol/L氯化钠/PBs 30~60min。
④PBS—BSA冲洗5min×3。
3.免疫标记与透射免疫电镜的原则及步骤基本相同。
免疫金银染色法举例(张留保等,1997)
(1)血细胞以PBS—BSA冲洗5min×3。
(2)2%多聚甲醛—戊二醛混合液固定,4℃,1h
(3)PBS或TBS反复冲洗5min×3。
(4)胶体金免疫标记程序(略)
(5)暗室显影液显影
(6)扫描电镜样品制样
(7)观察
作者在血细胞膜外显示了密集的金银粒标记(特异性标记膜的谷胱甘肽过氧化物酶及激素肽)。
4.常规扫描电镜标本处理
(1)PBS—BSA冲洗5min×3。
(2)后固定:2.5%戊二醛0.1mol/L磷酸缓冲液,时间视样本大小而定,一般室温30min左右。
(3)PBS—BSA洗5min×3。
(4)1%四氧化锇后固定1~2h
(5)系列梯度乙醇或丙酮脱水
(6)临界点干燥或冰冻干燥
(7)喷镀碳与金
(8)扫描电镜观察
三、冷冻蚀刻免疫电镜技术
冷冻蚀刻法(Freeze Ftching),也称冷冻复型法(Freeze Replica)或冷冻切断(Freeze Fracture),是研究生物膜结构的重要方法之一。其主要步骤首先是将样品在液氮中冷冻,然后放到真空喷镀仪中切断,切断后的切面上有细胞器,其间还有冻成洋的水分。再加热使冰升华,将水份蒸发,把细胞器的膜结构暴露出来,这一步骤就称为冷冻蚀刻。如不进行蚀刻就称为冷冻切断。向暴露的膜结构上喷镀铂—碳投影,再喷碳来加固。这样就在切断的样品表面形成一层复型膜。在此复型膜上印下了细胞切面的立体结构。从真空中取出样品,把复型膜下面的组织腐蚀掉,再把复型膜捞在铜网上,在透射电镜下观察复型膜。
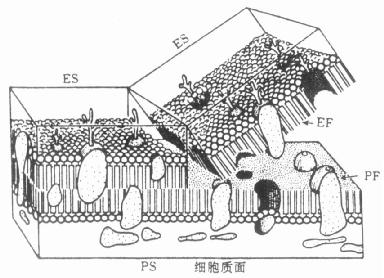
关于生物膜的分子结构,目前被大家公认的并为冷冻复型电镜观察所证实的是流动镶嵌型(图7-1),即脂质—球状蛋白质镶嵌模型。依照这上模型学说表明,生物膜是一种流动

图7-1 生物膜分子的流动镶嵌模型及冷冻断裂面图解
的、可塑的、镶嵌蛋白质分子的脂质双分子层的膜;脂质双分子层中每一分子分别具有两极,一端为亲水极,朝向膜的内、外表面,而另一端的疏水极朝向膜的中线部位,两排分子彼此相对,构成生物膜膜性结构的基础。蛋白质分子彼此相对有嵌入性和表在性两种,前者大约占蛋白质总量的3/4左右,外形近似球状,镶嵌在脂质分子层的不同深度内,而后者则大多附着于细胞膜的胞质面。在冷冻劈裂后,生物膜的水平断面大多发生在单位膜的疏水极。因此,膜的亲水部,分别命名为PS(与细胞质,核质或线粒体内基质相邻的面)和ES(与细胞外间隙或细胞内间隙或细胞内间隙相邻的面,如内质网腔、核质间隙、线粒体内、外膜之间的腔和其它各种泡的腔等)。膜的疏水部、亦即劈裂面分别叫做EF(面向细胞质、核质、或线粒体基质的面)和PF(向细胞外间隙或内间隙的面)。从70年代初期开始,冷冻蚀刻免疫电镜技术已开始在应用,但由于免疫标记必须在冷冻蚀刻步骤以前进行,所以仅能标记细胞外表面(ES)。80年代开始建立了断裂—标记细胞化学方法,将细胞膜劈开后,中央的两侧断面(EF与PF)以及各种细胞器的膜的各个表面及细胞质与核质都能被标记,为此技术的广泛应用创造了条件。应用此法还可对抗原与受体分子进行定量统计。
1.冷冻蚀刻表面标记免疫电镜技术
(1)新鲜或固定的细胞进行直接法或间接法免疫标记。
(2)PBS(pH7.5)冲洗3min×2,加入1mmol/l MgCl2蒸馏水洗洗3min×3,离心沉集细胞。
(3)将细胞团置于小纸板上,入液氮冷却的Freon中,取出入冷冻蚀刻仪中进行断裂操作,再于-100℃蚀刻1min 。
(4)制做断裂面复型。
(5)再次氯酸钠清洗复型,蒸馏水洗后进行观察。
本法可显示断裂暴露的PF位于中央,周围则是蚀刻后露出来的ES,标记物只出现在ES上。
2.断裂—标记免疫电镜技术
此法是先进行冷冻断裂,再做免疫标记,从而可以对断裂开的各种膜结构及胞浆断面进行标记。
(1)临界点干燥法
①固定:1.0%~2.5%戊二醛PBS液4℃1~2h,PBS冲洗3min×3。
如为细胞悬液,可加入30%BSA后加入1%戊二醛,使BSA凝胶化,将凝胶切成2mm左右的小块,用30%的甘油—PBS浸透后置于用液氮冷却的Freon中冷却。
②冷冻断裂,将冰冻的凝胶小块放在盛有液氮的培养皿中,培养皿放置于二氧化碳—液氮槽中,用预冷的解剖刀切割凝胶小块进行冷冻断裂。
③解冻,置碎块于30%甘油—1%戊二醛磷酸缓冲液中解冻。
④置换甘油,放入1mmol/l 氨基乙酰甘氨酸磷酸液去甘油,PBS冲洗,3min×2。
⑤免疫标记。
⑥1%锇酸,室温固定30min。
⑦系列梯度乙醇脱水,临界点干燥,喷镀铂—碳膜,次氯酸钠清洗复型,蒸馏水洗,捞于有Formvar 膜铜网上透射电镜观察。
(2)超薄切片法
步骤:①至⑤同临界点干燥法。
⑥1%锇酸,室温固定2h,系列酒精或丙酮脱水,常规电镜包埋。
⑦切半薄片,光镜定位合适的断裂部位,再切超薄切片,铀铅染色,透射电镜观察。
断裂标记法目前文献报告应用较多的是植物凝集素—胶体金免疫标记技术,常用的如刀豆球蛋白(Con A)-- 胶体金免疫标记技术,如第六章 所述,Con A 能与细胞膜中的甘露糖结合,能标记内质网膜、核被膜以及细胞膜的EF面,有助于糖蛋白在超微结构水平的定位。
为保证实验结果的准确性,每组实验在免疫标记阶段应设立对照组。对照组的设计同第一章 总论中的免疫对照染色。
参考文献
1.Altaman IG,et al.Rapid embedding of tissue Lowicryl K4m for immunoelectron microscopy.J Histochem Cytochem, 1984,32:1217
2.Bendayan M.Double immunocytochemical applying the protein A-Gold techniqnes.J Histochem Cytochem, 1982,30:81~85
3.Cai WQ(蔡文琴),et al.Colocalization of vasoactive substances in endothelial cells of human umbilical vessel.Cell Tissue Res, 1993,274:533~538
4.De Mey J.Clloidal gold probes in immunocytochemistry.In :Immunocytochemistry(Eds:Polak JH and Noordren SV)1983;82,wright PSG Bristol London Boston
5.Faulk WP and Taylor GM, Am immunocolloid method for the electron microscope.Immunocytochemistry, 1971,8:1081
6.Mclean I and Nakane PK.Periodase-Lysine-paraformaldehyxe fixative for immunoelectron microscopy.J Histochem Cytochem, 1974,22:1077
7.Ordronneaa P.Technique in immunocytochemistry(Eds:Bullock GR and Petrwoz P, 1982, 269~280
8.Roth J, et al.Application of the protein A-gold technique for electron microscopic demonstration of hormone.Endocrinology, 1981,108:247
9.Spour RC and Morlarty GC.Improvements of glycol Methacrylats.I.Its as an embodding medium for electron microscopic studies.J His-tochem Cytochem, 1977,25:163
10.Sterit WJ and Kreatzberg GW.Lectin binding by resting and reactive microglia.Neurocytol, 1986,16:249
11.Solt JW and Geuze HJ.A new method of preparing gold probes for multiple-labelling.Cytochemistry.Eur J Cell Biol, 1985,38(1):87
12 .Tokuyasu KT.Immunocytochemistry on ultrathin frozen sections.Histochem J, 1980,12:381
13.Vacca LL, et al.A modified peroxidase procedure for improved localization of tissue ontogens,localization of substance Pin rat spinal cord.J Histochem Cytochem, 1980,28:297~307
14.Wang Bao –Le, et al.Simplified purification and testing of colloidal gold probes.Histochemistry, 1985,83:109~115
15.Cai WQ(蔡文琴),et al.Localization of neuropeptide Y and atrial natriuretic petide in the endothelial cells of human umbilical blood ves-sels.Cell Tissue Res, 1993,272:175~181
16.蔡文琴.胶体金标记法在免疫细胞化学电镜的应用.解剖学杂志,1985,8(2):19
17.张承志.软型包埋剂GMA制作薄切片的原理及其应用.解剖学杂志,1986,9(1):73
18.李文镇主编.组织细胞冷冻复型图谱.人民卫生出版社,1981
19.孙榆,蔡文琴,李巍,等.改良低温包埋胶体金免疫电镜技术.第三军医大学学报,1991,13(8):417~472
(蔡文琴)