第一节 抗生物素—生物素免疫细胞化学染色法
一、基本原理
很早以前,人们就注意到给动物饲以大量的鸡蛋白,会引起明显的“维生素H缺乏症”,也称为“蛋白质伤害”。经研究发现,在鸡蛋白中含有一种碱性蛋白,分子量为68000,属于糖蛋白,当时命名为卵白素(Avidin),卵白素具有4个同维生素H(Riotin,又名生物素)亲合力极高的结合点。给动物饲以大量鸡蛋白所致的维生素H缺乏,就是由于卵白素和大量的维生素H结合所致。维生素H(以下统称生物素)是一种小分子的维生素,分子量为244,系转氨甲酰基化过程中的辅酶,它与卵白素之间有很强的亲合力,较之抗体对抗原的亲合力要高出100万倍,能够彼此牢固结合而不影响彼此的生物学活性。同时,生物素与卵白素都具有与其它示踪物质如荧光素、铁蛋白和过氧化酶等相结合的能力。免疫细胞化学工作者利用上述特性,建立了卵白素—生物素免疫染色系统。由于维生素H习惯上称为生物素,为便于理解,现在译名上统称卵白素为抗生物素或亲合素。所以卵白素—生物素免疫染色系统又称为抗生物素—生物素免疫染色法。
二、几中抗生物素—生物素染色法
1.抗生物素—生物素—过氧化酶复合物技术(Avidin Biotin –Peroxidase Complex technique, 简称ABC技术)
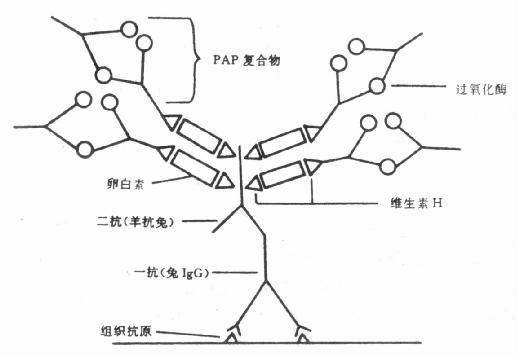
(1)基本原理:ABC法是Hsu 等于1981年在HRAB法和LAB法的基础上改良的,其特点是利用抗生物素分别连接生物素标记的第二抗体和生物素标记的酶。与LAB法和BRAB法不同的是第一抗体不为标记物所标记,生物素标记的第二抗体与ABC复合物相连接。复合物是将过氧化酶结合在生物素上、再将生物素—过氧化酶连接物与过量的抗生物素蛋白反应而制备的(图6-1),最后进行显色反应定位。

图6-1 ABC法
(2)操作步骤
①冰冻切片或石蜡切片均可。
②冰冻切片可用丙酮固定10min左右,0.01mol/l PBS (pH 7.2~7.6) 洗5min,更换3次。石蜡切片需经脱蜡,系列酒精至水。
③第一抗体,室温孵育15min。
④PBS洗5min,更换3次。
⑤加生物素标记的第二抗体(1:200左右),孵育15min。
⑥PBS洗5min,更换3次。
⑦加ABC复合物室温作用15min 。
⑧PBS洗5min,更换3次。
⑨用DAB—H2O2液(配法见附录)显色。
⑩复染。
⑾封片、观察。
ABC复合物的配制:经试验,生物素与抗生物素之比为1:4时,能获得最佳满意效果。即抗生物素10μg/ml加2.5μg/ml生物素,应用0.05mol/l Tris—HCl液,pH7.6,在应用前30min配制。
(3)ABC法的评价及实验注意事项
ABC法具有:①敏感性强:Hsu等应用ABC法与PAP法相比发现敏感性较PAP法高20~40倍能显示PAP法所不能显示的抗原。这是因为生物素与抗生物素间有较强的结合力,一个抗生物素分子具有可与生物素结合的4个活性部位,其中一部分可与生物素标记的过氧化物酶相结合,另一部分可与生物素标记的免疫球蛋白结合。生物素通过氨基与抗体或过氧化物酶分子相结合,一个过氧化物酶或免疫球蛋白分子可以结合多个生物素分子,从而增加了免疫球蛋白或过氧化物酶结合抗生物素的能力。在ABC反应中,抗生物素作为桥连接于生物素标记的酶和生物素标记的抗体之间,而生物素标记的过氧化物酶分子又可作为桥连接于抗生物素分子之间,于是形成了一个含有3个以上过氧化物酶分子(大于PAP复合物)的网格状复合物,敏感性极大提高。②特异性强,背景染色淡:由于敏感性高,第一抗体和第二抗体都可被稀释至尽可能的高度,减少了非特异性染色。③方法简便,节 约时间:由于ABC法敏感,操作的抗原抗体反应的时间可由PAP法所需的数天缩短为2h左右,各层抗体作用仅需15min。④国内上海生物制品所等单位制备的生物素—抗生物素染色药盒经质量鉴定符合标准,已提供国内市场。⑤由于生物素与抗生物素具有和多种示踪物结合的能力,可用于双重或多重免疫染色。
实验注意事项:
①内源性生物素活性及其消除:生物素是一种辅酶,是在脱羧基酶、羧基转换酶等催化的代谢环节 中所产生的羧基的中间载体,它存在于某些组织和细胞内,在应用ABC染色时会与抗生物素结合而产生非特异性染色。因此,对抗生物素结合性较高的组织如肝、肾、白细胞、脂肪组织和乳腺,在应用ABC方法前应预先以0.01%的抗生物素和0.01%的生物素溶液分别作用20min左右,以消除内源性抗生物素结合活性,每次作用后用PBS洗5min,更换3次。Nar-itoku和Taylor(1982)报告神经组织中的乳糖可与抗生物素结合产生假阳性反应,以2—甲基-O-甘露糖预孵育切片可封闭神经组织内乳糖分子上的结合点,从而阻止与抗生物素蛋白的结合。必要时,也可用0.3%H2O2—100%甲醇孵育以消除内源性过氧化 物酶活性。
②生物素制剂之间相互亲合性差异大,因此在应用ABC试剂时,应注意厂家和批号,对购进试剂应进行事先测试,以保证实验结果的稳定性。
③ABC试剂保存温度以4℃为佳,据报告保存可达两年之久,仍能获得满意效果,而在—20℃生物活性在短期内即被破坏。
2.桥抗生物素—生物素技术(Bridged Avidin –Biotin technique, 简称BRAB技术)
该技术方法是用生物素分别标记抗体和酶,然后以抗生物素为桥,把两者连接起来(图6-2)。
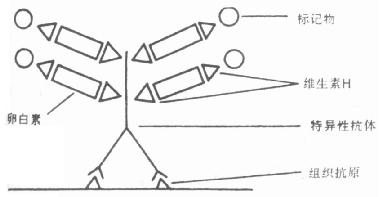
图6-2B RAB技术
检查抗原时,先用生物素标记的抗体与细胞(或组织内)的抗原反应,洗去未结合的抗体,加入抗生物素孵育后,洗去未结合的抗生物素,再加入已标记酶的生物素孵育,洗片,以细胞化学方法呈色反应。
3.标记生物素—抗生物素技术(Labelled Avidin—Biotin technique, LAB技术) 以生物素标记抗体作第一抗体,酶标记抗生物素作为第二抗体(图6-3)。操作步骤如下:
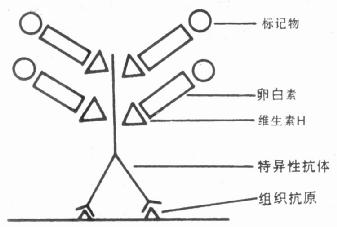
图6-3 LAB技术
(1)切片在含有25~50μg/ml生物素标记抗体(PBS液稀释)中孵育1h,室温。
(2)PBS洗2次,每次5min。
(3)用20~50μg/ml过氧化物酶标记的抗生物素液孵育90min,水洗。
(4)酶呈色反应。
BRAB法和LAB示是Guesdon及其同事们(1979)建立的,由于这二种方法都需以生物素标记第一抗体,应用不如ABC法普遍。但用于免疫细胞中免疫球蛋白的显示具有特异性。二者比较,LAB法手续较简便,但灵敏度较低。
生物素—抗生物素染色法采用免疫细胞化学染色中各种常用固定剂(见附录),均可获得较满意的结果。但有实验报告推荐“PLP”固定液(即过碘酸—赖氨酸—多聚甲醛固定液),其配制法亦见附录。PLP固定后,依次经系列蔗糖磷酸缓冲液(10%,15%,20%各5min),进行冰冻切片,贴于载片上,置室温风干30min或37℃3~4h或过夜。染色前用PBS湿润水化切片,可获得满意染色效果。