第十二章 钙磷代谢及微量元素
人体所需的营养素中包括部分无机盐。许多离子,主要是金属离子,在酶促反应过程中发挥作用;维护渗透压,主要为钠、钾、氯等;钙磷是骨骼的重要组成成分;此外,无机离子还参与信息传递,凝血过程等多种生理功能。
这些无机元素据人体中含量和需要量可分为常量元素和微量元素。体内含量较多(>5g),每天要量在100mg以上,如钙、磷、钾、钠、氯、镁等称为常量元素,而人体内含量甚微,每日需要量仅为μg或mg水平者,称为微量元素。包括铁、碘、铜、锌、锰、钴、钼、硒、铬、氟等。
本章重点讨论钙、磷的代谢及部分微量元素的作用。
第一节 钙磷代谢
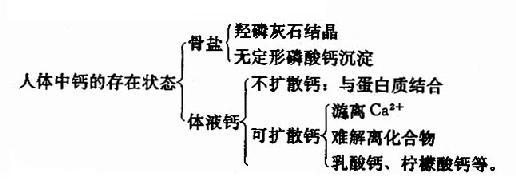
钙和磷是人体内含量最丰富的无机元素。在正常成人,钙约占体重1.5-2.2%,总量约为700-1400g。磷占体重0.8-1.2%,总量约400-800g。其中99%的钙和86%的磷以羟磷灰石的形式存在于骨和牙齿当中。其余分布于体液和软组织中,以溶解状态存在。
人体内钙的存在状态见下图所示。

钙和磷的代谢在许多方面是相互联系的,机体从食物中摄取钙和磷、又把它们从尿和粪中排泄,成人每日摄取和排泄量大致相等,处于动态平衡之中(图12-1)。
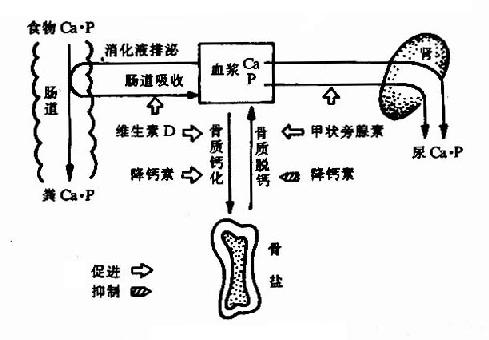
图12-1 钙磷代谢概貌
一、血钙和血磷
血钙指血浆中所含的钙,平均为9-11mg/dl。可分为可扩散钙(diffusible calcium)和非扩散钙(nondiffusible calcium)。非扩散钙指与血浆蛋白(主要为白蛋白)结合的钙。不易透过毛细血管壁。可扩散钙主要为游离Ca2+及少量与柠檬酸或其它酸结合的可溶性钙盐(表12-1)。
表12-1 正常人血浆钙各部分的含量
| 毫克/100毫升 | 毫克当量/升 | 占总量的% | |
| Ca2+ | 4.27 | 2.36 | 47.5 |
| 蛋白结合钙 | 4.56 | 2.28 | 46.0 |
| CaPO4 | 0.16 | 0.08 | 1.6 |
| 柠檬酸钙 | 0.17 | 0.08 | 1.7 |
| 其它未定钙 | 0.32 | 0.16 | 3.2 |
| 总计 | 9.93 | 4.96 | 100.0 |
血浆中发挥生理作用的主要为游离Ca2+,而血浆中Ca2+一蛋白结合钙和小分子结合钙之间呈动态平衡关系。此平衡受血浆PH影响,血液偏酸时,游离Ca2+浓度升高;相反,血液偏碱时,蛋白结合钙增多,游离Ca2+浓度下降。因此,临床上碱中毒时常伴有抽搐现象,与低血钙有关。
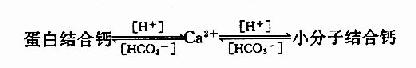
正常人血浆中无极磷的浓度为3.4?.0mg/dl、儿童稍高为4.5-6.5mg/dl。血浆中磷80~85%以HPO4形式存在。15-20%以H2PO4-形式存在,而PO43-的含量甚微。
血浆中钙、磷浓度关系密切,在以mg/dl表示时,二者的乘积([Ca]×[P])为30~40。当([Ca]×[P])>40,则钙和磷以骨盐形式沉积于骨组织;若([Ca]×[P])<35则妨碍骨的钙化,甚至可使骨盐溶解,影响成骨作用。
血钙和血磷含量的相对稳定依赖于钙、磷的吸收与排泄、钙化及脱钙间的相对平衡、而这些平衡又主要受维生素D3、甲状旁腺素和降钙素等激素的调节。
二、钙、磷的吸收与排泄
(一)钙、磷的吸收
体内钙和磷均由食物供给。正常成人每日摄取钙约1克、磷约0.8克。儿童及妊娠、哺乳期妇女需要量相应增加。
食物中所含钙主要为各种复合物,必须转变为游离Ca2+,才能被肠道吸收。当肠道内PH值<6时,有利于Ca2+的释放。因此,钙的吸收部位在小肠,而吸收率依次为十二指肠>空肠>回肠。食物中钙吸收率通常只有30%,当体内缺钙或生理需钙量增加时,吸收率可增高。
肠粘膜对钙的吸收机理较为复杂,既有跨膜转运,又有细胞内转运;既有逆浓度梯度的主动吸收,又有顺浓度梯度的被动扩散或易化转运。已知肠粘膜细胞内有多种钙结合蛋白(calnium binding protein,简写为CaBP),它与Ca2+有较强亲和力,可促进钙的吸收。磷的吸收与钙有密切关系,而且钙和磷的吸收又与钠的吸收和分布相互交织在一起,如图12-2所示。
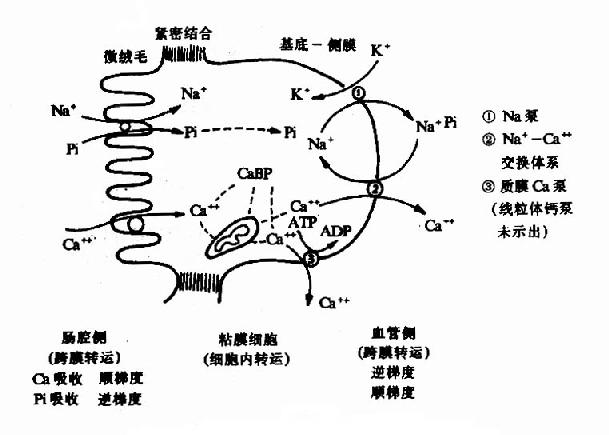
图12-2 肠粘膜对钙和磷的吸收示意图
如图122,Ca2+由肠腔进入粘膜细胞内是顺浓度梯度的,但由于微绒毛对Ca2+的通透性极低,故需要特殊的转运载体。Pi伴随着Na+的吸收进入粘膜细胞内,又随着Na+的泵出而至细胞外液(血管侧),后者虽然对Pi来说是顺梯度的,但要依赖Na+泵,所以有人将Pi的吸收称为“继发的主动转运”(secondary active transport)。至于CaBP的作用,现在认为它主要在细胞内转运过程中起作用,因为它对Ca2+的亲和力恰好介于质膜钙泵与线粒体膜钙泵对Ca2+的亲和力之间,是把线粒体蓄积的钙输送给基底一侧膜钙泵的一种输送蛋白。
食物中的磷主要以无机磷酸盐和有机磷酸酯两种形式存在,肠道主要吸收无机磷,有机含磷物则经水解释放出无机磷而被吸收。磷的吸收较易、吸收率可达70?0%。其吸收部位遍及小肠,以空肠吸收率最高。磷的吸收量比钙大,而且是逆电荷梯度进入小肠粘膜细胞,可见其有独立的吸收机制,目前对磷吸收机制尚未完全了解。肠道中酸碱性、食物成分以及血钙和血磷浓度均可影响钙和磷的吸收。
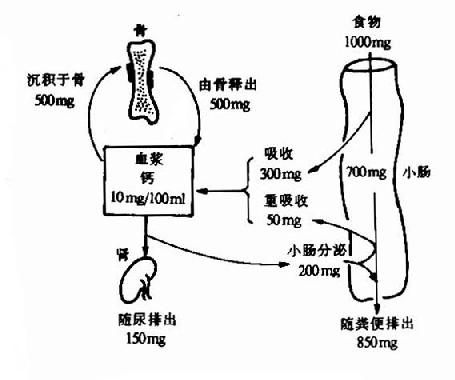
图12-3 人体每日钙的更新率
(二)钙和磷的排泄
人体排出钙主要有两条途径:约20%经肾排出,80%随粪便排出。肾小球每日滤出钙约10g,95%以上被肾小管重吸收,0.5-5%随尿排出。正常人从尿排出钙量较稳定,受食物钙量影响不大,但与血钙水平相关。血钙升高则尿钙排出增多。粪便中钙主要为食物中未吸收钙及消化液中钙。其量随钙的摄入量及肠收状态波动较大。
正常成人每日进出体内的钙量大致相等,即处于钙平衡状态。图12-3说明机体钙平衡的情况,图中数字为每日钙变化量的平均数。
磷亦通过肠道和肾脏排泄,以肾脏排泄为主。尿磷排出量占总排出量的60?0%。尿磷排出量取绝于肾小球滤过率和肾小管重吸收功能,并随肠道摄入量的变化而变化。
三、钙、磷与骨的钙化及脱钙
骨是一种特殊的结缔组织,不仅做为人体的支架组织,而且是人体中钙、磷的最大储库。通过成骨与溶骨作用,不断与细胞外液进行钙磷交换、对维持血钙和血磷稳定有重要作用。
(一)骨的组成
骨由无机盐、又称骨盐(bony salts)、有机基质和骨细胞等组成。骨盐增加骨的硬度,基质决定骨的形状及韧性,骨细胞在代谢中起主导作用。
骨盐占骨干重的65~70%,其主要成分为磷酸钙,占84%,其它还有CaCO3占10%,柠檬酸钙占2%,磷酸镁占1%,和Na2HPO4占2%等。骨盐约有60%以结晶的羟磷灰石(hydroxyapatite)形式存在,其余40%为无定形的CaHPO4。据认为后者可以转变为前者。羟磷灰石[Ca10(PO4)6(OH)2]是微细的结晶,亦称骨晶(bone crystal)。每克骨盐含有约1016个结晶,总的表面积可达100平方米,体液中其他离子如Ca2+、Mg2+、Na+、Cl-、HCO3-、F-,柠檬酸根等可吸附在羟磷灰石的晶格之间。骨晶性质稳定,不易解离,但在其表层进行离子交换的速度较快。
骨中镁离子占体内镁离子总量的50%,骨中钠离子也占体内钠离子总量的35%,而且大部分钠易于交换。所以骨骼不仅是身体的支持组织,也是贮存大量钙、磷、钠、镁的器官,在维持体液电解质浓度的稳定性上具有重要作用。此外,骨盐中的Ca2+还可与体液中的H+交换,当体液中[H+]增多(酸中毒)时,由于Ca2+H+交换,可致骨盐溶解。
骨基质包括胶原和非胶原化合物。胶原约占90%以上。非胶原蛋白中含量较多的是骨钙素(osteocalcin)和骨连接素(osteonectin)。骨钙素为一种依赖维生素K的小分子酸性蛋白质,分子量约6000,其谷氨酸残基在γ位羧化为γ-羧基谷氨酸,与羟磷灰石、Ca2+有很高亲和力、骨连接素是附着于胶原的一种糖蛋白,易与羟磷石结合,可能作为骨盐沉积的核心。
(二)成骨作用与钙化
骨的生长、修复或重建过程,称为成骨作用(osteogenesis)。成骨过程中,成骨细胞先合成胶原和糖白多糖等细胞间质成分,形成所谓“骨样质”(osteoid),继后骨盐沉积于骨样质中,此过程称为钙化(calcification)。
关于钙化的机理,尚未完全阐明,研究表明下列变化可能参与和影响骨盐的沉积:
(1)电镜下可见成骨细胞表面突起形成很多囊泡。囊泡膜富含类脂并具有很高的碱性磷酸酶活性,可水解基质中多种磷酸酯,使无机磷浓度升高。囊泡中富含丝氨酸磷酯,能与Ca2+紧密结合,故能有效摄取周围基质中Ca2+。此外,成骨细胞具有钙泵作用,可从周围间隙中浓集钙。这些因素共同作用,使骨组织钙化局部Ca2+和HPO42-升高,使[Ca]×[P]积升高,利于钙盐的沉积。
(2)正常血中存在钙化抑制物,如焦磷酸盐(pyrophosphate),而成骨细胞囊泡中的磷酸酶可水解焦磷酸盐,一方面解除其抑制作用,另一方面提供了充分的无机磷作为骨盐沉着的原料。

(3)基质中的骨连接素可能提供羟磷灰石结晶形成的“晶核”,促使羟磷石结晶的形成。骨钙素则可直接结合羟磷灰石,避免羟磷灰石在局部堆积,使之有规律地沉积于胶原上。
(4)实验表明,胶原纤维的成熟和骨样组织的正常,是骨盐沉着的重要前提。
骨的生成和钙化是一个复杂的生物过程,受多种因素的影响和调节,此方面的研究正在深入进行,并取得了一些可喜的进展。如发现了多种与骨生成相关的蛋白及细胞因子等。
(三)溶骨作用与脱钙
骨在不断的新旧更替之中,原有旧骨的溶解和消失称为骨的吸收(bone resorption)或溶骨作用(osteolysis)。溶骨作用包括基质的水解和骨盐的溶解,后者又称为脱钙(decalcification)。溶骨作用同成骨作用一样,是通过骨组织细胞的代谢活动完成的。溶骨作用主要由破骨细胞引起,可分为细胞外相和细胞内相两相完成。
破骨作用起始于细胞外。破骨细胞通过接触骨面的刷状缘,溶酶体释放出多种水解酶类,如胶原酶可水解胶原纤维,糖苷酶水解氨基多糖。同时,破骨细胞通过糖元分解代谢产生大量乳酸,丙酮酸等酸性物质扩散到溶骨区,使局部酸性增加,促使羟磷灰石从解聚的胶原中释出。破骨细胞产生柠檬酸能与Ca2+结合形成不解离的柠檬酸钙,降低局部Ca++的浓度,从而促进磷酸钙的溶解。继后,多肽、羟磷灰石等经胞饮作用进入破骨细胞,并与溶酶体溶合形成次级溶酶体。在此多肽水解为氨基酸、羟磷灰石转变为可溶性钙盐。最后,氨基酸、磷及Ca2+从破骨细胞释放入细胞外液,再入血,可参与血磷、血钙的组成。因骨的有机质主要为胶原,溶骨作用增强时,血及尿中羟脯氨酸增高。因此可将血及尿中羟脯氨酸的量作为溶骨程度的参考指标。
正常成人,成骨与溶骨作用维持动态平衡,每年骨的更新率约1?%。骨骼发育生长时期,成骨作用大于溶骨作用。而老年人则骨的吸收明显大于骨的生成,骨质减少而易发生骨质疏松症(osteoporosis)。骨盐在骨中沉积或释放,直接影响血钙、血磷水平,在平时骨中约有1%的骨盐与血中的钙经常进行交换维持平衡,因此血钙浓度与骨代谢密切相关。
四、钙磷代谢的调节
体内钙、磷代谢的平衡主要由甲状旁腺素、1,25-(OH)2D3和降钙素来调节。
(一)甲状旁腺素(Parathormone,PTH)
1.合成及分泌
甲状旁腺素是由甲状旁腺主细胞合成和分泌的一种单链多肽激素,成熟PTH含84个氨基酸残基,分子量约为9500。是维持血钙恒定的主要激素。
PTH的合成遵循典型的胞内多肽合成途径。首先合成的是含115个氨基酸的前甲状旁腺激素原(Pre Pro PTH)。在粗面内质网切除N端25个氨基酸的信号肽,降解为激素原(Pro PTH),含90个氨基酸残基,无生理活性。Pro PTH在高尔基体中进一步切去N端6个氨基酸残基,组装为成熟的、具生物活性的PTH分泌颗粒。(图12-4)。
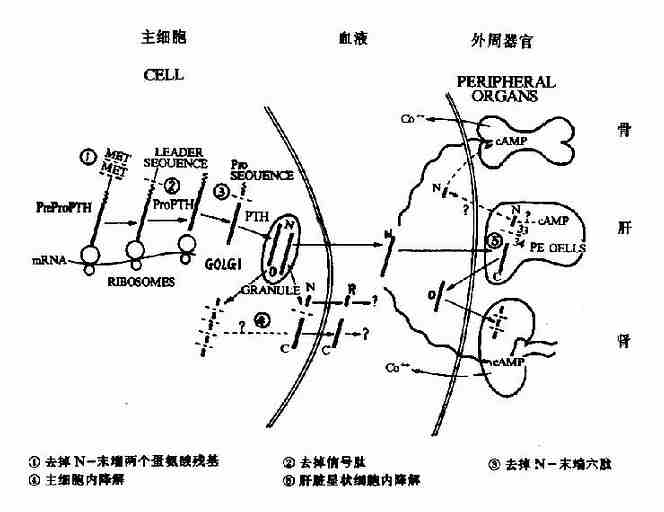
图12-4 PTH及其前体的合成、分泌及代谢
完全相同的生物活性。主要受体结合位点在1-6,它的切除会导致全部生物活性丧失。C-未端片断不具有生物活性,但决定PTH的免疫原性,这在PTH放射免疫测定时应注意。
PTH在血液中的半衰期仅数分钟,甲状旁腺细胞内PTH的储存亦有限。因而,分泌细胞不断进行PTH的合成及分泌。血钙是调节PTH水平的主要因素,血钙不仅调节PTH的分泌,而且影响PTH的降解。低血钙的即刻效应(几秒钟内)是刺激贮存的PTH的释放,而持续作用主要是抑制PTH的降解速度。后者是调节外周血PTH水平的主要机制。当血Ca2+水平下降时,体内PTH降解速度减慢,血中PTH水平增高。此外,1,25-(OH)2D3与PTH分泌也有关系,当血中1,25-(OH)2D3增多时,PTH的分泌减少,降钙素则可促进PTH分泌。一方面是通过降低血钙的间接作用,另一方面可直接刺激甲状旁腺分泌PTH。
(二)生理作用PTH作用的靶器官是肾脏,骨骼和小肠。PTH作用于靶细胞膜
上腺苷酸环化酶系统,增加胞浆内cAMP及焦磷酸盐(PPi)的水平。前者促进线粒体内Ca2+向胞浆透出,后者则作用于细胞膜外侧,增加Ca2+向细胞内透入,使细胞浆Ca2+浓度升高,于是细胞膜上的“钙泵”被激活,将Ca2+大量输送到细胞外液。PTH作用的总效应是升高血钙。
1.对骨的作用
PTH具有促进成骨和溶骨的双重作用。实验研究表明小剂量PTH可促进成骨作用,而大剂量则可促进溶骨作用。PTH可刺激骨细胞分泌胰岛素样生长因子I(IGF桰),从而促进骨胶原和基质的合成,利于成骨作用。临床上利用此作用,给骨质疏松症患者连续使用小剂量PTH治疗,取得良好疗效。另一方面PTH能使骨组织中破骨细胞的数量和活性增加,破骨细胞分泌各种水解酶,并且产生大量乳酸和柠檬酸等酸性物质,使骨基质及骨盐溶解,释放钙和磷到细胞外液。但PTH只引起血钙升高;而血磷却减少,其原因在于PTH对肾脏的作用。
2.对肾脏的作用
PTH对肾脏作用出现最早,主要是增加肾近曲小管对Ca2+的重吸收,降低肾磷排泄阈并抑制肾小管对磷的重吸收。其机理是通过细胞膜受体和cAMP系统,改变细胞膜对Ca2+通透性,使Ca2+内流增多、胞浆内Ca2+浓度升高,减低腔面对Na+通透性,Na+桯+交换减少,Na+、HCO3-排出增多,磷排出也相应增加。同时,通过浆膜面的“钙泵”使Ca2+进入血液,其结果使尿钙减少,尿磷增多,最终使血钙升高,血磷降低。
3.对小肠的作用
PTH对小肠的钙、磷吸收的影响,一般认为是通过激活肾脏1α-羟化酶,促进1,25-(OH)2D3的合成而间接发挥作用的,此效应出现得较为缓慢。
(二)1,25-(OH)2D3
1.合成及调节
1,25-(OH)2D3是一种激素,由维生素D3在体内代谢生成,是维生素D3在体内的主要生理活性形式。维生素D3及其前体在皮肤、肝、肾等经过一系列的酶促反应生成1,25-(OH)2D3,再经血液运输到小肠、骨及肾等靶器官发挥生理作用。
皮肤:胆固醇代谢中间产物在皮肤分布较多。在紫外线照射下先转变为前维生素D3(previtamin D3),后者在体温条件下经36小时自动异构化为维生素D3(图12-5)。
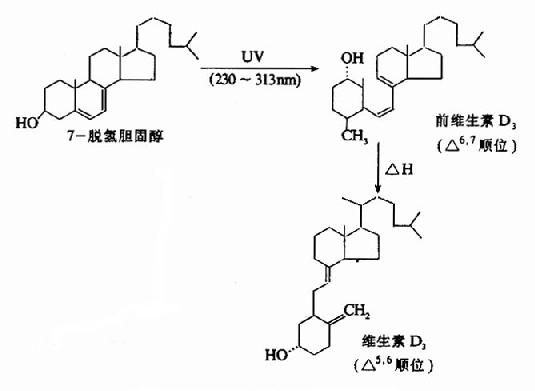
图12-5 维生素D3的生成
(2)肝脏:皮下转化生成及肠道吸收的维生素D3入血后,与维生素D结合蛋白(DBP)结合运送到肝脏,在肝细胞微粒体中维生素D-25羟化酶催化,转变为25-(OH)D3。维生素D-25羟化酶受产物25-(OH)D3的反馈抑制。合成的25-(OH)D3再与DBP结合而运输,它是血浆中维生素D3的主要形式。
(3)肾脏:肝脏生成的25-OH)D3经血运往肾脏,在肾近曲小管上皮细胞线粒体内1α-羟化酶系(包括黄素酶、铁硫蛋白和细胞色素P450)的作用下,转变成1,25-(OH)2D3。此外,肾脏中还有24,25-(OH)2D3及1,24,25-(OH)2D3等代谢产物。其活性均较弱。(图12-6)。
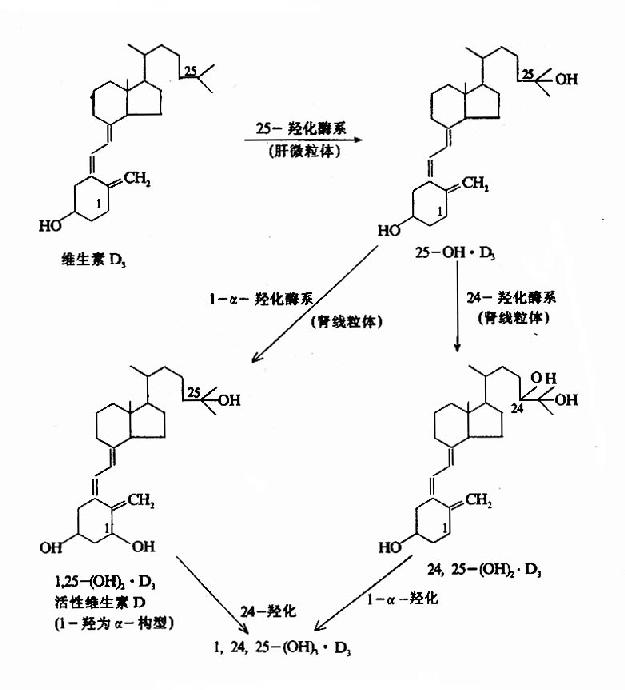
图12-6 维生素D3的代谢
(4)调节:1,25-(OH)2D3的合成受多种因素影响和调控。主要通过1α-羟化酶调节,主要影响因素有PTH、血液和细胞外液磷酸盐浓度、1,25-(OH)2D3及血钙等。
PTH是1α-羟化酶的主要调节者。PTH能促进1α-羟化酶合成,抑制24α-羟化酶,从而使25-(OH)D3转变为1,25-(OH)2D3增多,转变为24,25-(OH)2D3减少。低血钙由于使PTH升高而刺激1,25-(OH)2D3的生成。低血磷可刺激1α-羟化酶活性,且低血磷刺激1,25-(OH)2D3合成作用不依赖于PTH。此外,维生素D3不仅不受1α-羟化酶作用,而且还抑制1α-羟化酶。
2.1,25—OH)2D3的生理作用
1,25-(OH)2D3作用的靶器官是小肠、骨,而对肾脏作用较弱。
(1)对小肠的作用:1,25-(OH)2D3能促进小肠对钙、磷的吸收,这是其最主要的生理功。1,25-(OH)2D3与小肠粘膜细胞内的特异胞浆受体结合,进入细胞核内,促进DNA转录生成mRNA,从而使钙结合蛋白(calcium binding protein,CaBp)和 Ca2+-Mg2+ATP酶)合成增高。从而使进Ca2+的吸收转运。同时1,25-(OH)2D3可影响小肠粘膜细胞膜磷脂的合成及不饱合脂肪酸的量,增加Ca2+的通透性,利于肠腔内Ca2+的吸收。1,25—OH)2D3促进Ca2+吸收同时伴随磷吸收的增强,但对磷吸收的作用机制尚未了解清楚。
(2)对骨的作用,1,25-(OH)2D3对骨亦有溶骨和成骨的双重作用。体外实验证明,1,25-(OH)2D3能刺激破骨细胞活性和加速破骨细胞的生成,从而促进溶骨作用。在体内则与PTH协同作用,促进破骨细胞增生,并增强其破骨作用。另一方面,由于1,25-(OH)2D3增加小肠对钙、磷的吸收,提高血钙、血磷,又促进钙化。同时,1,25-(OH)2D3还刺激成骨细胞分泌胶原等,促进骨的生成。所以,在钙、磷供应充足时,1,25-(OH)2D3主要促进成骨。当血钙降低、肠道钙吸收不足时,主要促进溶骨,使血钙升高。
(3)对肾的作用1,25—(OH)2D3可促进肾小管对钙、磷的重吸收。但此作用较弱,处于次要地位。只在骨骼生长和修复期,钙、磷供应不足情况下较明显。
1,25-(OH)2D3总的调节效果是使血钙、血磷增高。
(三)降钙素(Calcitonin CT)
1.化学本质
降钙素是由甲状腺滤泡旁细胞(又称C细胞)所分泌的一种单链多肽类激素,由32个氨基酸组成,分子量为3500。N-末端1,7位氨基酸为半胱氨酸,以二硫键相连,形成一个封闭环,C-末端为脯氨酸。分子内部的氨基酸顺序变化较大,不同种类CT,32个氨基酸中只有9个位置是相同的(图127)。但从体结构来看,这几种CT的结构又很相似,其所有亲水和疏
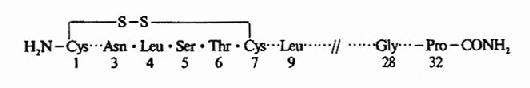
图12-7 猪、牛、鲑鱼和人类降钙素的共性结构
水氨基酸残基的位置相对固定。如疏水基的酪氨酸、苯丙氨酸、亮氨酸在分子中有规律的间隔出现(4、9、12、16、19、22位),带电荷的酸性氨基酸都在15和30位上。如天冬氨酸、谷氨酸、甘氨酸。所以每种CT对各种哺乳动物都有生物活性。一般认为CT生物活性有赖于分子中32个氨基酸结构的完整性,目前对此说法有一些新的见解,并取得一些新进展。例如人工合成一种自1922氨基酸残基单个缺失或片断缺失的鲑鱼CT同类物,其降钙作用为天然鲑鱼CT的2倍。
2.CT的合成与分泌
在人甲状腺C细胞中以CT mRNA为模板的最初翻译产物是分子量约15000的蛋白,经过修饰先转变为分子量12000的产物,最后转变为3500的成熟CT。血钙是影响CT分泌的主要因素。血钙升高可刺激CT的分泌。血钙降低则抑制CT的分泌,但CT合成的速度不受影响,因而细胞内CT含量增高。甲状旁腺功能低下患者,其C细胞中CT含量亦增多。
3.CT的生理功能
CT作用的靶器官也主要为骨和肾,其作用与PTH相反,其作用是抑制破骨作用,抑制钙、磷的重吸收,降低血钙和血磷。
目前已发现在骨、肾、肠粘膜、精子等细胞上有CT受体,CT与受体结合激活腺苷酸环化酶,通过cAMP发挥生物效应。近来发现随着细胞内Ca2+增加而出现CT的功能效应,有人提出Ca2+是CT作用于破骨细胞的第二信使。
(1)CT对骨的作用:CT直接抑制破骨细胞的生成,又可加速破骨细胞转化为成骨细胞,因而增强成骨作用,抑制骨盐溶解、降低血钙、血磷浓度。
(2)CT对肾的作用:CT直接抑制肾小管对钙、磷离子的重吸收,从而使尿磷,尿钙排出增多,同时还可通过抑制肾1α—羟化酶而减少1,25-(OH)2D3的生成而间接抑制肠道对钙、磷的吸收率,结果使血浆钙、磷水平下降。
(3)对小肠作用:通过抑制1,25-(OH)2D3生成间接抑制钙的吸收,一般认为无直接作用。
综上可见,PTH,1,25-(OH)2D3、及CT均可调节钙、磷代谢,三者相互协调,相互制约、以维持血中钙、磷的动态平衡。三者对钙、磷代谢的调总结于表12-2。
表12-2 三种激素对钙、磷代谢的调节
| PTH | 1,25-(OH)2D3 | CT | |
| 血钙 | ↑ | ↑ | ↓ |
| 血磷 | ↓ | ↑ | ↓ |
| 小肠钙吸收 | ↑ | ↑↑ | ↓ |
| 小肠磷吸收 | ↑ | ↑ | ↓ |
| 肾钙重吸收 | ↓ | ↑ | ↓ |
| 溶肾作用 | ↑↑ | ↑ | ↓ |
| 成骨作用 | ↑ | ↑ | ↑ |