第二节 呼 吸 链
呼吸链(respiratory chain)是由一系列的递氢体(hydrogen transfer)和递电子体(eletron transfer)按一定的顺序排列所组成的连续反应体系,它将代谢物脱下的成对氢原子交给氧生成水,同时有ATP生成。实际上呼吸链的作用代表着线粒体最基本的功能,呼吸链中的递氢体和递电子体就是能传递氢原子或电子的载体,由于氢原子可以看作是由H+和e组成的,所以递氢体也是递电子体,递氢体和递电子体的本质是酶、辅酶、辅基或辅因子。
一、呼吸链的组成
构成呼吸链的递氢体和递电子体主要分为以下五类
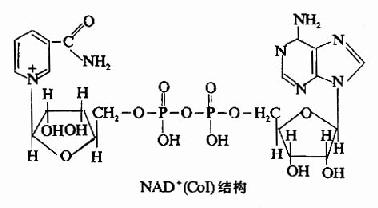
(一)尼克酰胺腺嘌呤二核苷酸(NAD+)或称辅酶I(CoI)。
为体内很多脱氢酶的辅酶,是连接作用物与呼吸链的重要环节,分子中除含尼克酰胺(维生素PP)外,还含有核糖、磷酸及一分子腺苷酸(AMP),其结构如下:

NAD+的主要功能是接受从代谢物上脱下的2H(2H++2e),然后传给另一传递体黄素蛋白。
在生理pH条件下,尼克酰胺中的氮(吡啶氮)为五价的氮,它能可逆地接受电子而成为三价氮,与氮对位的碳也较活泼,能可逆地加氢还原,故可将NAD+视为递氢体。反应时,NAD+的尼克酰胺部分可接受一个氢原子及一个电子,尚有一个质子(H+)留在介质中。
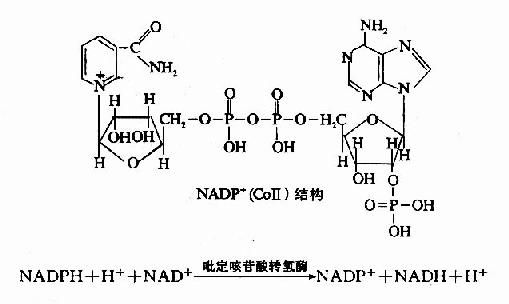
此外,亦有不少脱氢酶的辅酶为尼克酰胺腺嘌呤二核苷酸磷酸(NADP+),又称辅酶Ⅱ(CoⅡ),它与NAD+不同之处是在腺苷酸部分中核糖的2′位碳上羟基的氢被磷酸基取代而成。
当此类酶催化代谢物脱氢后,其辅酶NADP+接受氢而被还原生成NADPH+H+,它须经吡啶核苷酸转氢酶(pyridine nucleotide transhydrogenase)作用将还原当量转移给NAD+,然后再经呼吸链传递,但NADPH+H+一般是为合成代谢或羟化反应提供氢。
(二)黄素蛋白(flavoproteins)
黄素蛋白种类很多,其辅基有两种,一种为黄素单核苷酸(FMN),另一种为黄素腺嘌呤二核苷酸(FAD),两者均含核黄素(维生素B2),此外FMN尚含一分子磷酸,而FAD则比FMN多含一分子腺苷酸(AMP),其结构如下:
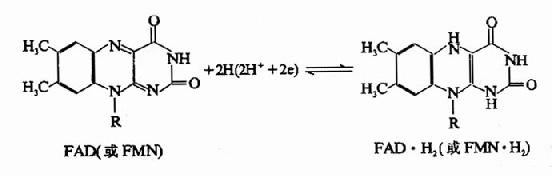
在FAD、FMN分子中的异咯嗪部分可以进行可逆的脱氢加氢反应。

FAD或FMN与酶蛋白部分之间是通过非共价键相连,但结合牢固,因此氧化与还原(即电子的失与得)都在同一个酶蛋白上进行,故黄素核苷酸的氧化还原电位取决于和它们结合的蛋白质,所以有关的标准还原电位指的是特定的黄素蛋白,而不是游离的FMN或FAD;在电子转移反应中它们只是在黄素蛋白的活性中心部分,而其本身不能作为作用物或产物,这和NAD+不同,NAD+与酶蛋白结合疏松,当与某酶蛋白结合时可以从代谢物接受氢,而被还原为NADH,后者可以游离,再与另一种酶蛋白结合,释放氢后又被氧化为NAD+。
多数黄素蛋白参与呼吸链组成,与电子转移有关,如NADH脱氢酶(NADh dehydrogenase)以FMN为辅基,是呼吸链的组分之一,介于NADH与其它电子传递体之间;琥珀酸脱氢酶,线粒体内的甘油磷酸脱氢酶(glycerol phosphate dehydrogenase)的辅基为FAD,它们可直接从作用物转移还原当量H++e reducing equivalent)到呼吸链,此外脂肪酰CoA脱氢酶与琥珀酸脱氢酶相似,亦属于FAD为辅基的黄素蛋白类,也能将还原当量从作用物传递进入呼吸链,但中间尚需另一电子传递体称为电子转移黄素蛋白(electrontransferring flavoprotein,ETFP,辅基为FAD)参与才能完成。
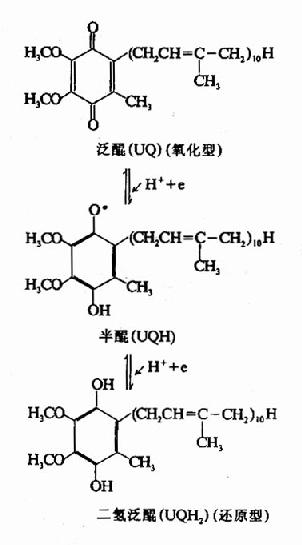
(三)铁硫蛋白(ironsulfur proteins,Fe-S)
又称铁硫中心,其特点是含铁原子。铁是与无机硫原子或是蛋白质肽链上半胱氨酸残基的硫相结合,常见的铁硫蛋白有三种组合方式(a)单个铁原子与4个半胱氨酸残基上的巯基硫相连。(b)两个铁原子、两个无机硫原子组成(2Fe-2S),其中每个铁原子还各与两个半胱氨酸残基的巯基硫相结合。(c)由4个铁原子与4个无机硫原子相连(4Fe4S),铁与硫相间排列在一个正六面体的8个顶角端;此外4个铁原子还各与一个半胱氨酸残基上的巯基硫相连(图6-1)。
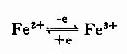
图6-1 铁硫蛋白结构
(a)单个铁与半胱氨酸硫相连 (b)2Fe-2S (c)4Fe-4S
铁硫蛋白中的铁可以呈两价(还原型),也可呈三价(氧化型),由于铁的氧化、还原而达到传递电子作用。
在呼吸链中它多与黄素蛋白或细胞色素b结合存在。
(四)泛醌(ubiquinone,UQ或Q)
亦称辅酶Q(coenzyme Q),为一脂溶性苯醌,带有一很长的侧链,是由多个异戊二烯(isoprene)单位构成的,不同来源的泛醌其异戊二烯单位的数目不同,在哺乳类动物组织中最多见的泛醌其侧链由10个异戊二烯单位组成。
泛醌接受一个电子和一个质子还原成半醌,再接受一个电子和质子则还原成二氢泛醌,后者又可脱去电子和质子而被氧化恢复为泛醌。
(五)细胞色素体系
1926年Keilin首次使用分光镜观察昆虫飞翔肌振动时,发现有特殊的吸收光谱,因此把细胞内的吸光物质定名为细胞色素。细胞色素是一类含有铁卟啉辅基的色蛋白,属于递电子体。线粒体内膜中有细胞色素b、c1、c、aa3,肝、肾等组织的微粒体中有细胞色素P450。细胞色素b、c1、c为红色细胞素,细胞色素aa3为绿色细胞素。不同的细胞色素具有不同的吸收光谱,不但其酶蛋白结构不同,辅基的结构也有一些差异。
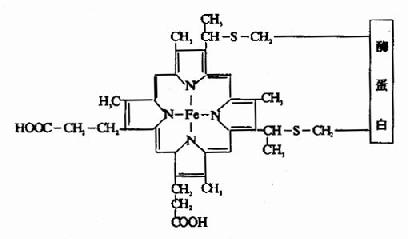
细胞色素c为一外周蛋白,位于线粒体内膜的外侧。细胞色素C比较容易分离提纯,其结构已清楚。哺乳动物的Cyt c由104个氨基酸残基组成,并从进化的角度作了许多研究。Cyt c的辅基血红素(亚铁原卟啉)通过共价键(硫醚键)与酶蛋白相连(见图6-2),其余各种细胞色素中辅基与酶蛋白均通过非共价键结合。
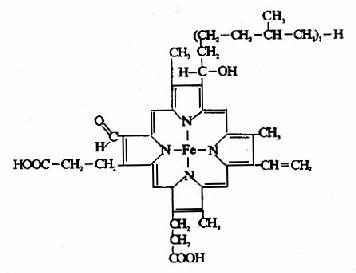
图6-2 细胞色素C的辅基与酶蛋白的联接方式
细胞色素a和a3不易分开,统称为细胞色素aa3。和细胞色素P450、b、c1、c不同,细胞色素aa3的辅基不是血红素,而是血红素A(见图6?)。细胞色素aa3可将电子直接传递给氧,因此又称为细胞色素氧化酶。
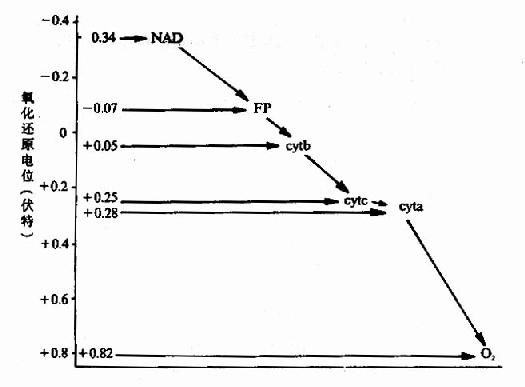
图6-3 血红素A结构式
铁卟啉辅基所含Fe2+可有Fe2+←→Fe3++e的互变,因此起到传递电子的作用。铁原子可以和酶蛋白及卟啉环形成6个配位键。细胞色素aa3和P450辅基中的铁原子只形成5个配位键,还能与氧再形成一个配位键,将电子直接传递给氧,也可与CO、氰化物、H2S或叠氮化合物形成一个配位键。细胞色素aa3与氰化物结合就阻断了整个呼吸链的电子传递,引起氰化物中毒。
二、呼吸链中各种传递体的排列顺序
(一)确定排列顺序的方法
1.根据各种组分的标准氧化还原电位来确定。标准氧化还原电位的数值表示氧化还原能力的大小,标准氧化还原电位负值越大,其还原性越强,容易被氧化;标准氧化还原电位正值越大,其氧化性越强,容易被还原。因此呼吸链中各种组分的排列顺序应当由低电位依次向高电位排列(图-4)。
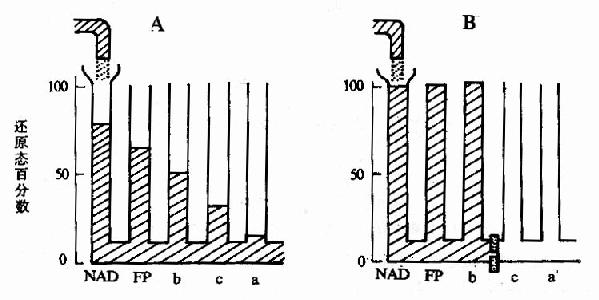
图6-4 各种传递体的标准氧化还原电位
2.根据在有氧条件下氧化反应达到平衡时各种传递体的还原程度来确定。Chance和Williams使用分光光度法测定离体的线粒体在有氧条件下三羧酸循环反应达到平衡时,呼吸链中各种传递体的还原程度。反应达到平衡时从底物一侧到氧一侧的各种传递体的还原程度应当是递减的,底物的一侧最高,氧一侧最低,如下表中数据所示。
表6-1 有氧动态平衡时电子传递体的还原程度
| 传递体 | NAD | FP | Cyt b | Cyt c | Cty aa3 |
| 还原型% | 53 | 20 | 16 | 6 | 1 |
FP:黄素蛋白
这种情况好象物理学上的联通管,图6?A中,若进水量等于出水量,即流量达到平衡时,离进水口最近的水管中水位最高,离出水管最近的水管中水位最低,从进水管到出水管水位逐渐减低,若把水流视为电子流,就是上述实验中的情况。
3.使用特异的抑制剂 特异的抑制剂能阻断呼吸链中的特定环节,阻断部位的底物一侧的各种传递体应为还原型,阻断部位的氧一侧的各种传递体应为氧化型,正象我们阻断联通管的底部一样,阻断部位以前的各水管中水是满的,而阻断部位以后的各水管中水均流光(见图6-5,B)。
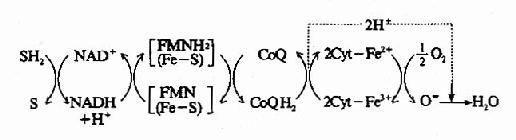
图6-5 有氧氧化稳定时各种传递体的还原太分数
A.不加抑制剂 B.加入抗霉A阻断
复合物Ⅰ:催化NADH氧化、CoQ还原。
复合物Ⅱ:催化琥珀酸氧化、CoQ还原
复合物Ⅲ:催化Co QH2氧化、Cyt c还原
复合物Ⅳ:催化Cyt c氧化、O2还原
表6-2 使用抗霉素A前后各种递电子体的还原型百分数
| FP | Cyt b | Cyt c+c1 | Cty aa3 | |
| 琥珀酸 | 40 | 25 | 19 | 4 |
| 琥珀酸+抗霉素A | 100 | 100 | 0 | 0 |
从表中可以看出,FP、Cyt b位于抗霉素A阻断部位之前,Cyt c、cl、aa3位于阻断部位之后。用不同的抑制剂作此实验,就可以确定呼吸链中各种传递体的排列顺序。
4.在体外实验中,将线粒体分成各种复合物,检测其各自催化的反应,再将其重组,检测其催化能力。
美国格林(Green)等实验室成功地将呼吸链分离成具有催化活性的四种复合物以及CoQ和Cytc.检测各个复合物的功能发现:
可以看出CoQ在复合物Ⅰ与Ⅲ,Ⅱ与Ⅲ之间传递还原当量,Cyt c在复合物Ⅲ与Ⅳ之间传递还原当量。他们又将这四种复合物1:1:1:1的比例混合,加上CoQ和Cyt c重组,基本上恢复了线粒体原有的催化能力。
借助上述实验方法,呼吸链各组分的排列顺序已基本明确,但仍有些不一致的看法,其中以CoQ至细胞色素C这一部分研究得还很不清楚,对于Fe-S和CoQ的定位和数量也有争议。
(二)氧化呼吸链
1.NADH氧化呼吸链 人体内大多数脱氢酶都以NAD+作辅酶,在脱氢酶催化下底物SH2脱下的氢交给NAD+生成NADH+H+,在NADH脱氢酶作用下,NADH+H+将两个氢原子传递给FMN生成FMNH2,再将氢传递至CoQ生成CoQH2,此时两个氢原子解离成2H++2e,2H+游离于介质中,2e经Cyt b、c1、c、aa3传递,最后将2e传递给1/2O2,生成O2-,O2与介质中游离的2H+结合生成水,综合上述传递过程可用图6-6表示。
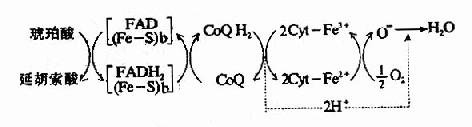
图6-6 NADH氧化呼吸链
SH2:作用物;(Fe-S):铁硫中心;Cyt:细胞色素
2.琥珀酸氧化呼吸链 琥珀酸在琥珀酸脱氢酶作用下脱氢生成延胡索酸,FAD接受两个氢原子生成FADH2,然后再将氢传递给CoQ,生成CoQH2,此后的传递和NADH氧化呼吸链相同,整个传递过程可用图6-7表示。
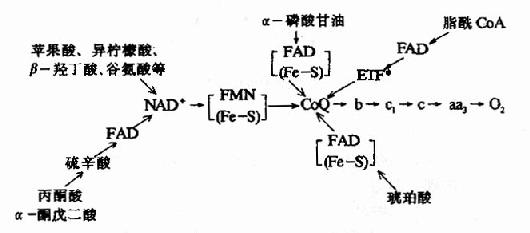
图6-7 琥珀酸氧化呼吸链
(Fe-S):铁硫中心:b:琥珀酸脱氢酶复合体的细胞色素
3.线粒体氧化呼吸链总结 线粒体中物质代谢会生成大量的NADH+H+和FADH2-它们可来自丙酮酸氧化脱羧、三羧酸循环、脂肪酸的β-氧化和L-谷氨酸的氧化脱氨等反应,现将某些重要底物氧化时的呼吸链总结于图6-8。
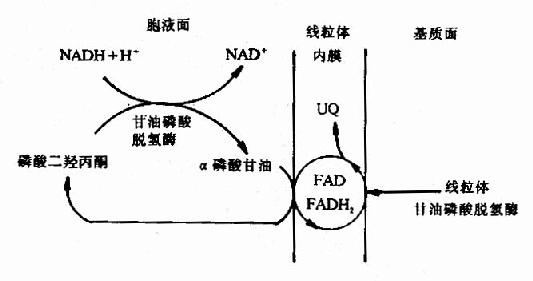
图6-8 线粒体中某些底物氧化时的呼吸链
*ETF:电子传递黄素蛋白,辅基为FAD
三、胞浆中NADH的转移
体内很多物质氧化分解产生NADH,反应发生在线粒体内,则产生的NADH可直接通过呼吸链进行氧化磷酸化,但亦有不少反应是在线粒体外进行的,如3-磷酸甘油醛脱氢反应,乳酸脱氢反应及氨基酸联合脱氨基反应等等。由于所产生的NADH存在于线粒体外,而真核细胞中,NADH不能自由通过线粒体内膜,因此,必须借助某些能自由通过线粒体内膜的物质才能被转入线粒体,这就是所谓穿梭机制,体内主要有两种穿梭机制。
1.α磷酸甘油穿梭(glycerolα-phosphate shuttle)
该穿梭机制主要在脑及骨骼肌中,它是借助于α-磷酸甘油与磷酸二羟丙酮之间的氧化还原转移还原当量,使线粒体外来自NADH的还原当量进入线粒体的呼吸链氧化,具体过程如图6-9。
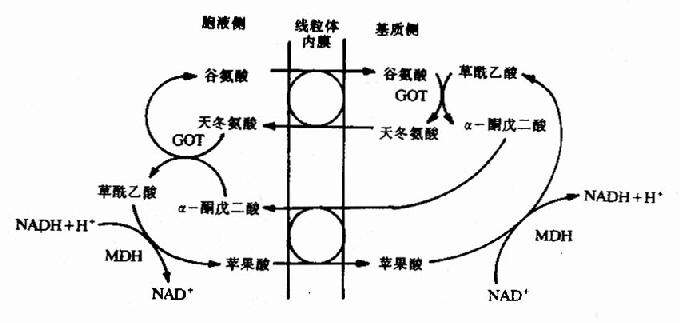
图6-9 α磷酸甘油穿
当胞液中NADH浓度升高时,胞液中的磷酸二羟丙酮首先被NADH还原成α磷酸甘油(3-磷酸甘油),反应由甘油磷酸脱氢酶(辅酶为NAD+)催化,生成的α磷酸甘油可再经位于线粒体内膜近外侧部的甘油磷酸脱氢酶催化氧化生成磷酸二羟丙酮。线粒体与胞液中的甘油磷酸脱氢酶为同工酶,两者不同在于线粒体内的酶是以FAD为辅基的脱氢酶,而不是NADH+,FAD所接受的质子、电子可直接经泛醌、复合体Ⅲ、Ⅳ传递到氧,这样线粒体外的还原当量就被转运到线粒体氧化了,但通过这种穿梭机制果只能生成2分子ATP而不是3分子ATP。
2.苹果酸,天冬氨酸穿梭(malate aspartate shuttle):
这种穿梭机制主要在肝、肾、心中发挥作用,其穿梭机制比较复杂,不仅需借助苹果酸、草酸乙酸的氧化还原,而且还要借助α酮酸与氨基酸之间的转换,才能使胞液中来的NADH的还原当量转移进入线粒体氧化,具体过程如图6-10。

图6-10 苹果酸天冬氨酸穿梭
GOT:谷草转氨酸;MDH:苹果酸脱氢酶
当胞液中NADH浓度升高时,首先还原草酰乙酸成为苹果酸,此反应由苹果酸脱氢酶催化,胞液中增多的苹果酸可通过内膜上的二羧酸载体系统与线粒体内的α酮戊二酸交换;进入线粒体的苹果酸,经苹果酸脱氢酶催化又氧化生成草酰乙酸并释出NADH,还原当量从复合体I进入呼吸链经CoQ、复合体Ⅲ、Ⅳ传递,最image/005061360后给氧,所以仍可产生3分子ATP,与在线粒体内产生的NADH氧化相同。与此同时线粒体内的α酮戊二酸由于与苹果酸交换而减少,需要补充,于是在转氨酶作用下由谷氨酸与草酰乙酸进行转氨基反应,生成α酮戊二酸和天冬氨酸,天冬氨酸借线粒体膜上的谷氨酸天冬氨酸载体转移系统与胞液的谷氨酸交换,从而补充了线粒体内谷氨酸由于转氨基作用而造成的损失,进入胞液的天冬氨酸再与胞液中α酮戊二酸进行转氨基,重新又产生草酰乙酸以补充最初的消耗,从而完成整个穿梭过程。