第二节 电离辐射对细胞的作用
一、细胞的辐射敏感性
机体各类细胞对辐射的敏感性不一致。Bergonie 和Tribondeau提出细胞的辐射敏感性同细胞的分化的程度成反比,同细胞的增殖能力成正比。Casaret按辐射敏感性由高到低,将人类和哺乳动物细胞分为4类(表3-1)。从总体上说,不断生长、增殖、自我更新的细胞群对辐射敏感,稳定状态的分裂后细胞对辐射有高度抗力。而多能性结缔组织,包括血管内皮细胞,血窦壁细胞,成纤维细胞和各种间胚叶细胞也较敏感,介于表3-1的Ⅱ、Ⅲ类之间。
表3-1 哺乳类细胞辐射敏感性分类
| 细胞类型 | 特 性 | 举 例 | 辐射敏感性 |
| Ⅰ增殖的分裂间期细胞(vegetative intermitosis cells) | 受控分裂 分化程度最低 |
造血干细胞 肠隐窝细胞 表皮生长细胞 |
高 |
| Ⅱ分化的分裂间期细胞(differentiating intermitosis cells) | 受控分裂 分裂中不断分化 |
幼稚血细胞 | |
| 结缔组织细胞 (Conective tissue cells) |
|||
| Ⅲ可逆性分裂后细胞(reverting postmitotic cells) | 无受控分裂 可变分化 |
肝细胞 | |
| Ⅳ稳定性分裂后细胞(fixed postmitotic cells) | 不分裂 高度分化 |
神经细胞 肌肉细胞 |
低 |
二、细胞周期的变化
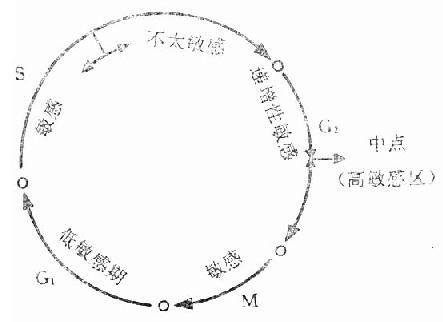
辐射可延长的细胞周期,但不同阶段的辐射敏感性不同(图3-3)。处于M期的细胞受照很敏感,可引起细胞即刻死亡或染色体畸变(断裂、粘连、碎片等);可不立刻影响分裂过程,而使下一周期推迟,或在下一次分裂时子代细胞夭折。C1期的早期对辐射不敏感,后期则较为敏感,RNA、蛋白质和酶合成抑制,延迟进入S期。S前期亦较为敏感,直接阻止DNA合成,而在S期的后期敏感性降低,是则于此时已完成DNA合成,即使DNA受损亦可修复之故。G2期是对辐射极敏感的阶段,分裂所需特异蛋白质和RNA合成障碍,因而细胞在G2期停留下来,称“G2阻断”(G2block),是照射后即刻发生细胞分裂延迟主要原因。

图3-3 细胞周期各阶段的辐射敏感性
三、染色体畸变
细胞在分裂过程中染色体的数量和结构发生变化称为染色体畸变(chromosome aberration)。畸变可以自然发生,称自发畸变(spontaneous aberration)。许多物理、化学因素和病毒感染可使畸变率增高。电离辐射是畸变诱发因素,其原因是电离粒子穿透染色体或其附近时,使染色体分子电离发生化学变化而断裂。
(一)染色体数量变化
照射时染色体发生粘着,在细胞分裂时可能产生染色体不分离现象,致使两个子细胞中染色体不是平均分配,生成非整倍体(aneuploid)细胞。
(二)染色体结构变化
1.染色体型畸变:当染色体在复制之前受照射(即细胞处于G1期或S期初期受照射),染色体发生畸变之后再进行复制,称染色体型畸变。断片、着丝粒环、双着丝粒体、相互易位、倒位及缺失等畸变属于这一类(图3-4)。
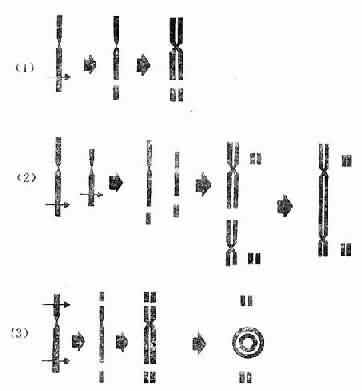
图3-4 某些染色体畸变形成示意图
(1)断片, (2)双着丝点 (3)环
2.染色单体型畸变:当染色体复制之后受照射(即细胞处于S期后期或G2期受照射),在一个染色单体臂上发生断裂或裂隙,称为染色单体型畸变(chromatid aberration)。单体断片、单体互换等属这一类。
电离辐射诱发的畸变以染色体型畸变为主,尤以断片,环和双着丝粒体等畸变,在反映辐射效应的程度方面更有意义。
四、细胞死亡
(一)细胞死亡类型
1.间期死亡(intermitotic death):细胞受照射后不经分裂,在几小时内就开始死亡,称间期死亡,又称即刻死亡。体内发生间期死亡的细胞分为二类:一类是不分裂或分裂能力有限的细胞,如淋巴细胞和胸腺细胞,受几百mGy照射后即发生死亡;另一类是不分裂和可逆性分裂的细胞,如成熟神经细胞、肌细胞和肝、肾细胞等,需要照射几十至几百Gy才发生死亡。细胞间期死亡发生率随照射剂量增加而增加,但达到一定峰值后,再增加照射剂量,死亡率也不再增加。间期死亡的原因是核细胞的破坏,其机理主要是由于DNA分子损伤和核酸、蛋白质水解酶被活化,导致染色质降解,组蛋白外溢,发生细胞核固缩、裂解。照射后膜结构的破坏、细胞能量代谢障碍,也是促成间期死亡的因素。
2.增殖死亡(reproductive death):细胞受照射后经过1个或几个分裂周期以后,丧失了继续增殖的能力而死亡,称增殖死亡,也称延迟死亡。体内快速分裂的细胞,如骨髓细胞受数Gy射线照射后数小时至数天内即发生增殖死亡。分裂细胞在受到很大剂量照射后也可发生间期死亡。增殖死亡的机理主要是由于DNA分子损伤后错误修复和染色体畸变等原因导致有丝分裂的障碍。
(二)剂量存活曲线
剂量存活曲线(dode survival curve)是反映照射剂量与细胞死亡率之间的关系,分析受照射细胞群体辐射效应的一种模式。在培养皿上培养有增殖能力的哺乳类细胞,观察细胞集落形成率,以每一集落代表1个存活细胞。其集落形成率随照射剂量增加而减少。以集落形成率代表细胞存活率与照射剂量在半对数座标纸上作图即构成剂量存活曲线(图3-5)。
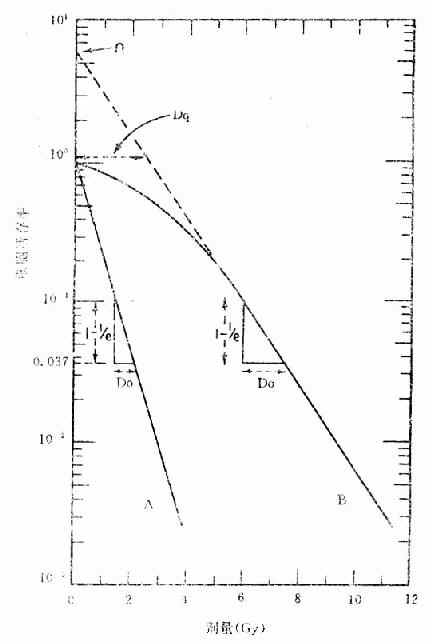
图3-5 哺乳类细胞典型剂量存活曲线
剂量存活曲线的形状有两种,图中A线是简单的指数曲线,生物分子的灭活、原核细胞死亡,或高LET辐射哺乳类细胞,多符合这样的剂量存活曲线。B线是带“肩”的指数曲线,“肩”表示在低剂量区细胞存活率降低缓慢,“肩”的大小反映了细胞对亚致死损伤的耐受力或修复能力。大多数哺乳类细胞受低LET辐射照射符合带“肩”的剂量存活曲线。
通常用D37、D0、Dq和n等参数来表示剂量存活曲线的特征。
D37是指存活曲线上存活率由1降至0.37所需的剂量。
D0称平均致死剂量(mean lethal dose),是指存活曲线指数部分,即直线部分存活率每降低至0.37所需的剂量。D0是该直线斜率的倒数。D0的大小反映了细胞的辐射敏感性,哺乳类细胞的D0值多在1~2Gy之间。(图中e为自然对数的底,等于2.718,1/e≈0.37)。
Dq称拟阈剂量(quasithreshold dose),是在剂量存活曲线上存活率为1处划一横坐标的平行线,与B线直线部分延长线相交,其所对应的剂量即为Dq。在A线上Dq=0,故D37=D0。
n称外推值(extrapolation number)是剂量存活曲线B的直线部分的延长线与纵座标的交点。
Dq和n值都反映曲线“肩”部的大小,在放射生物学和放射治疗学中常用D0、Dq和n等参数比较各类的细胞辐射敏感性和修复能力。
五、细胞损用力的修复
(一)亚致死损伤修复
亚致死损伤是指细胞接受辐射能量后所引起的损伤不足以使细胞致死,如果损伤积累起来,就可以引起细胞死亡。但若给予足够的时间,则细胞有可能对这种损伤进行修复,称亚致死损伤修复(sublethal damage repair,SLDR)。所以将一定剂量进行分次照射,每次照射中间给予一定间隔,细胞的死亡率比同等剂量一次照射明显减少。
(二)潜在致死损伤修复
潜在致死损伤是指照射后细胞暂未死亡,但如不进行干预,细胞将会发生死亡。假如改变受照射细胞所处状态。例如置于不利于细胞分裂的环境中,则受损伤细胞可得到修复而免于死亡,称潜在致死损伤修复(potentially lethal damage repair,PLDR)。